Jorge Amador C., QF., MSc.
Farmacéutico Clínico UPC adulto
Hospital Clínico San Borja Arriarán
Past president de la división de Farmacia Clínica de la Sochimi
La sepsis es una de las principales causas de mortalidad en las Unidades de Cuidados Intensivos (UCI) y afecta a más de 18 millones de pacientes en el mundo. El inicio rápido y precoz, de una adecuada terapia antibiótica dentro de la primera hora del diagnóstico de sepsis o shock séptico, es primordial para reducir la mortalidad y morbilidad. Sin embargo, el abordaje terapéutico de estos pacientes está condicionado por su fisiopatología particular.
Los antibióticos son el grupo terapéutico de mayor interés por varias razones: la sepsis grave y shock séptico son las principales causas de ingreso a UCI, la creciente resistencia antibiótica asociada a elevados costos económicos, la utilización de muchos recursos sanitarios y ,por ende. la alta morbimortalidad.
Especialmente en UCI, la administración correcta de los antimicrobianos es un desafío diario, existiendo muchos factores que se ven involucrados en la farmacocinética (PK) y la farmacodinamia (PD) de los antibióticos utilizados, entre ellos se encuentran: los liquidos utilizados, los cambios en el peso corporal, la hipoalbuminemia, el edema, los valores de hematocrito, entre otros. Los cuales implican cambios en la vida media del fármaco (t½), en su volumen de distribuición (Vd) y en su eliminación (Cl). Así, la sepsis incrementa la permeabilidad capilar con secuestro de liquidos en el tercer espacio, la disfunción organica multiple origina disminución de la depuración de los antimicrobianos, por lo que, teniendo en cuenta todos estos factores, resulta necesario conocer las concentraciones plasmáticas del antibióticos utilizado siempre que sea posible. Por lo anterior, la aplicación de la farmacocinética clínica aparece como herramienta útil para optimizar la terapia farmacológica, limitando los efectos adversos por sobredosificación y/o evitando inefectividad por subdosificación en estos pacientes.
Para su efectividad, se requiere cumplir ciertas relaciones farmacocinéticas y farmacodinámicas (PK/PD) entre la concentración plasmática alcanzada y el tiempo que esa concentración se mantiene sobre la concentración inhibitoria mínima (CIM) del patógeno causante de la infección. La combinación de ambos parámetros puede permitir una aproximación sobre la respuesta terapéutica que se obtendrá, ya que ninguno por sí solo puede entregar información completa.
Por otra parte, para optimizar la efectividad de los antibióticos, es muy importante considerar las propiedades PK/PD, dosis de carga, tiempo de infusión, uso de terapia de reemplazo renal continua, entre otras. Estas consideraciones adquieren especial relevancia en el contexto de los pacientes críticos en que pueden coexistir múltiples variables que perturben significativamente las concentraciones plasmáticas de los fármacos administrados, tales como: disfunciones orgánicas agudas (y agudas sobre crónicas), hipoalbuminemia, interacciones farmacológicas, hiperdinamia, volumen de distribuición incrementado, hiperfiltración renal (ClCr ≥130 ml/min), por mencionar algunas. Un aspecto muy importante es que en pacientes con sepsis y shock séptico el esquema antibiótico intravenoso empírico debe iniciarse con la máxima dosificación recomendada para cada agente, independiente de la presencia de disfunción renal. Los ajustes por injuria renal, se realizan en un segundo tiempo e idealmente con medición del aclaramiento de creatinina y de acuerdo a niveles plasmáticos del antimicrobiano.
Según eso, los antibióticos se clasifican como concentración tiempo-dependiente (tiempo/CIM) (ßlactámicos; penicilinas, cefalosporinas y carbapenémicos) dado por el gráfico de concentración plasmática/tiempo, que ha permitido hacer la terapia antimicrobiana más segura y efectiva. Es la cantidad total administrada la que determina su eficacia. Los antibióticos concentración-dependiente (Peak/CIM) (aminoglucósidos) deben alcanzar una concentración de fármaco libre al menos 10 veces mayor que la CIM del patógeno sin efecto tóxico para el paciente. Como presentan efecto postantibiótico, luego de decaer la concentración plasmática siguen ejerciendo acción bactericida.
Finalmente, los antibióticos del área bajo la curva sobre la CIM (ABC/CIM), cuantifica la exposición del antibiótico en un tiempo determinado (glicopéptidos como vancomicina y quinolonas). Asimismo, se requiere alcanzar una razón de ABC/CIM ≥ 400 para vancomicina y de 30/1 para quinolonas. (Gráfico 1)
La administración clásica de los antibióticos por infusión intermitente puede comprometer el alcance del índice PK/PD y puede implicar oscilaciones de concentraciones plasmáticas que pueden llevar a niveles insuficientes. Es por esto, que la infusión prolongada o continua, sería una forma de administración superior, ya que garantizaría concentraciones en steady state (Css) superiores a la CIM durante más tiempo y, como consecuencia, mejores resultados clínicos.
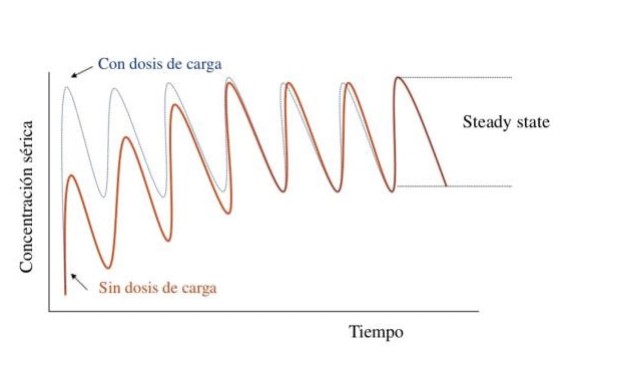
En pacientes con sospecha de sepsis o shock séptico se recomienda iniciar un esquema antibiótico de amplio espectro para todos los focos y microorganismos potencialmente involucrados en el cuadro clínico y/o infección, considerando siempre la dosis de carga. (Gráfico 2)
En conclusión, el uso de antibióticos en pacientes críticos requieren de monitoreo permanente para modificar las estrategias de tratamiento y optimizar su efectividad; importante la valoración clínica, el descalaje terapéutico guiado por cultivos microbiólogicos y factores específicos en cada UCI. Se ha observado que las alteraciones fisiopatológicas que manifiesta cada paciente crítico, puede generar cambios significativos y dinámicos en uno o en varios de los procesos farmacocinéticos. Debido a esto, es necesario individualizar las terapias de medicamentos que pueden salvar vidas, como son los antibióticos. Ellos representan uno de los medicamentos más usados en las UCIs y requieren manejarse bajo las relaciones PK/PD antes definidas. Lo esperable es que la farmacocinética clínica se convierta en una herramienta cada vez más utilizada para el apoyo individualizado de las terapias en UCI. Ello permitirá mejorar el uso de medicamentos y, a la vez, maximizar su eficacia, reducir las potenciales toxicidades o el fracaso terapéutico por subdosificación.
Gráfico 1: Índices PK/PD: predicción de eficacia.
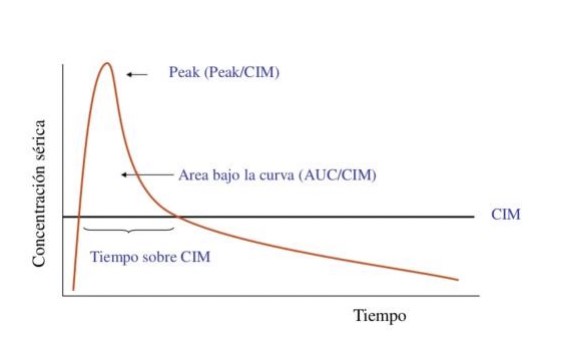
Gráfico 2: Concentración vs Tiempo con y sin dosis de carga.