Inicio precoz de norepinefrina en shock séptico ¿Tiene sustento clínico?
- Trabajo de Revisión
- 3001 vistas
Resumen
El shock es una las principales patologías que requieren monitoreo y un manejo oportuno en los servicios de emergencia, pabellones quirúrgicos y unidades de cuidados intensivos (UCI). La reversión farmacológica de la reducción del tono vasomotor es uno de los pilares centrales en su manejo. En este contexto, la norepinefrina (NE), surge como la catecolamina de primera elección frente a un cuadro de hipotensión severa. En los últimos años, varios reportes han puesto en evidencia la importancia del momento de inicio del soporte vasopresor en estados de shock. La presente revisión narrativa, resume la fundamentación fisiológica y la evidencia clínica disponible sobre el uso precoz de NE en el shock séptico.
Palabras clave: Fluidos; Norepinefrina; Pacientes críticos; Reanimación; Shock séptico.
Introducción
El shock es una las principales patologías que requieren monitoreo y un manejo oportuno en los servicios de emergencia, pabellones quirúrgicos y unidades de cuidados intensivos (UCI). Esta es una entidad de elevada mortalidad, cuya resolución requiere de medidas de reanimación inicial y avanzada que implican conocimientos sobre fluidos, drogas vasoactivas y de la fisiopatología del tipo de shock en evolución1,2.
Independiente de la etiología del shock, revertir farmacológicamente la reducción del tono vasomotor (vasoplejia) es uno de los pilares centrales en su manejo, dado que permite un rápido rescate de la situación hemodinámica que pone en riesgo la vida3. Entre las drogas vasoactivas disponibles, la norepinefrina (NE), es la catecolamina de primera elección en el contexto de hipotensión severa. En la década de los 90’, en un estudio experimental de shock séptico, Sautner et al.4 demostraron que la administración de NE no generaba una alteración significativa del flujo sanguíneo esplácnico, ni un mayor deterioro de la integridad intestinal. De Backer et al.5, mediante un estudio fisiológico en pacientes con shock séptico previamente reanimados con fluidos, documentaron que la infusión de NE preservó mejor la circulación esplácnica en comparación a otras catecolaminas. En la actualidad, la NE cuenta con varios estudios clínicos que han establecido su efectividad con un aceptable perfil de seguridad y, en situaciones de urgencia, incluso puede ser iniciada transitoriamente por vía venosa periférica mientras se avanza en el diagnóstico etiológico y se instala un acceso venoso central6,7,8,9,10,11.
La NE fue descubierta en 1946 en estudios sobre neurotransmisores del sistema nervioso central. Como catecolamina endógena, su liberación es parte de la respuesta neuroendocrina inespecífica del sistema nervioso ante una amenaza inminente que pone en riesgo la supervivencia. El uso clínico de NE en el manejo de diferentes estados de shock ha sido descrito en la literatura médica desde la década de los sesenta12,13. En 1993, un pequeño ensayo clínico aleatorizado monocéntrico reportó que la NE era más efectiva y segura que dopamina en pacientes con shock séptico14, hallazgos preliminares que posteriormente fueron corroborados por estudios multicéntricos15,16. A lo largo de los años se ha comprendido mejor la acción farmacológica de la administración de NE y los efectos fisiológicos que genera17,18,19. En la figura 1, se exponen de manera esquemática los efectos fisiológicos de la NE en el sistema cardiovascular y sus interacciones.
La presente revisión narrativa, resume la fundamentación fisiológica y la evidencia clínica disponible sobre el uso precoz de NE en el shock séptico.
Regulación de la presión arterial
En individuos sanos la regulación de la presión arterial es multifactorial y se mantiene estable debido a complejos mecanismos en los que participan el sistema nervioso autónomo y los centros de regulación cardiovascular del sistema nervioso central, factores vasodilatadores y vasoconstrictores, así como el riñón. La perfusión de los distintos órganos se mantiene constante dentro de un rango “adecuado” de presión arterial media (PAM) que oscila entre
60 a 100 mmHg aproximadamente, lo cual asegura un nivel aceptable de flujo sanguíneo que permite el normal funcionamiento orgánico20. En estados de shock se pueden presentar perturbaciones de la autorregulación del flujo sanguíneo, por lo que el mantenimiento de la PAM cobra particular relevancia para garantizar la perfusión tisular. Varios estudios han documentado buenos resultados clínicos en pacientes con shock séptico en quienes se ha empleado como meta hemodinámica una PAM ≥65 mmHg21,22,23. Este es el fundamento que sustenta la recomendación actual del objetivo de PAM en la reanimación inicial del shock séptico24,25. Por otra parte, en pacientes con hipertensión arterial (HTA) crónica, la curva de autorregulación puede estar desplazada hacia la derecha, por lo que esta población pudiera requerir un nivel más elevado de PAM para evitar la hipoperfusión de territorios nobles, como el cerebro, corazón y riñones, en situaciones de shock. En este contexto, el estudio SEPSISPAM (Sepsis and Mean Arterial Pressure)26, un ensayo multicéntrico y aleatorizado que incluyó 776 pacientes con shock séptico evaluó el impacto de dos diferentes niveles de PAM (65-70 mmHg vs. 80-85 mmHg) sobre la mortalidad a 28 días. Los autores no encontraron reducción significativa de la mortalidad en la población global, ni en el subgrupo de pacientes con HTA crónica. De este modo, considerando la información actualmente disponible, no es posible recomendar un nivel mayor de PAM como meta durante la reanimación inicial del shock séptico24,25. No obstante, algunos pacientes con HTA crónica pueden requerir mayores niveles de PAM, lo cual debe ser determinado en forma dinámica e individualizada, mediante la evaluación de diferentes marcadores de perfusión tisular24,27.
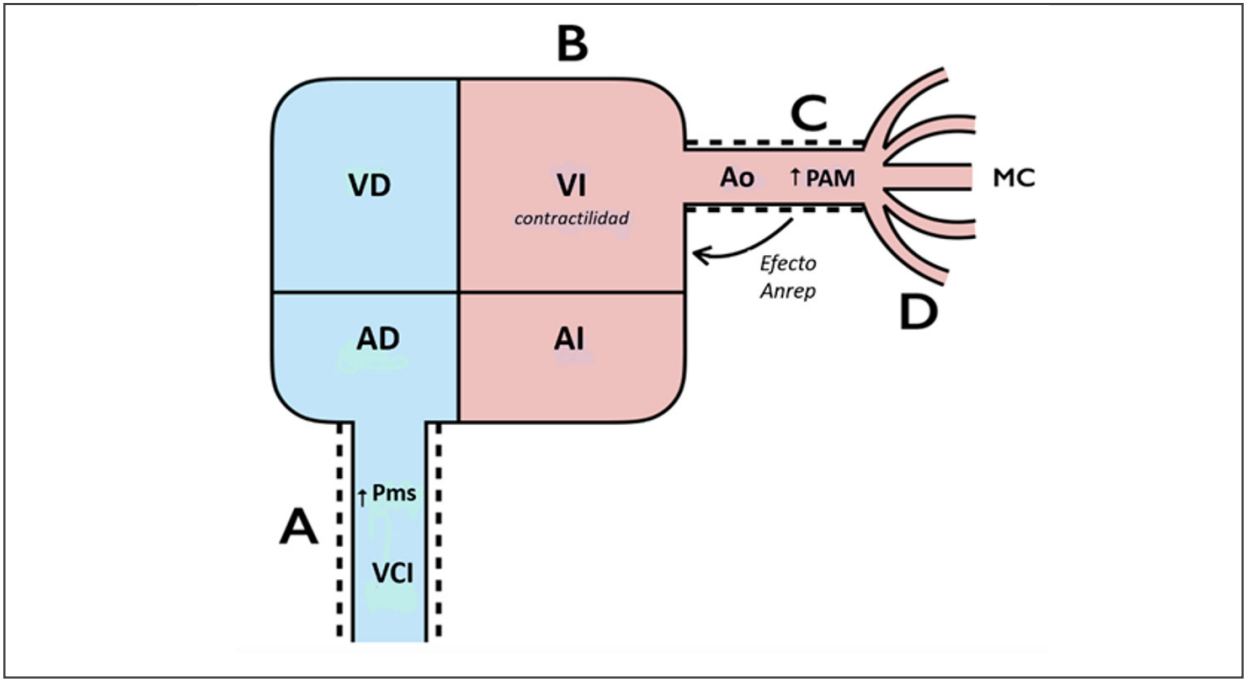
Figura 1: Efectos circulatorios propuestos para la norepinefrina. A. Al aumentar el tono venoso vascular, la Pms aumenta, lo que da como resultado una presión mejorada “aguas abajo” para retorno venoso y, por lo tanto, la precarga. B. La estimulación del receptor ß1 y también el efecto Anrep aumentarían la contractilidad del VI. C. Restauración del tono arterial mediante la estimulación de los receptores α1 y, por tanto, la presión arterial. D. Mejora del flujo sanguíneo microcirculatorio.
VCI: vena cava inferior, Pms: presión media de llenado sistémico, AD: aurícula derecha, VD: ventrículo derecho, AI: aurícula izquierda, VI: ventrículo izquierdo, Ao: aorta, PAM: presión arterial media, MC: microcirculación. Gentileza Dr. Glenn Hernández.
Duración y severidad de la hipotensión
Varpula et al.28 llevaron a cabo un análisis retrospectivo en 111 pacientes con shock séptico con el objetivo de identificar las variables hemodinámicas que se asociaban a mal pronóstico en las primeras 6 horas de reanimación. Los autores encontraron una diferencia significativa en la mortalidad relacionada a la PAM. Se evidenció que aquellos pacientes que fallecieron a los 28 días tuvieron hipotensión más severa y prolongada en el tiempo. Dünser et al.29 reportaron que la ocurrencia de uno o más episodios de hipotensión (PAM <60 mmHg) en las primeras 24 horas de ingreso a la UCI se asoció a un riesgo de muerte 3 veces mayor. En este contexto, la versión 2018 del bundle de reanimación de la Surviving Sepsis Campaign recomienda el inicio de vasopresores, con un objetivo de PAM ≥65 mmHg, dentro de la primera hora si el paciente persiste hipotenso pese a la administración de fluidos30.
El estudio CENSER (Early Use of Norepinephrine in Septic Shock Resuscitation) fue un ensayo clínico aleatorizado doble ciego controlado con placebo (fase II), que incluyó 310 pacientes con shock séptic31. El objetivo principal del estudio fue evaluar la tasa de control de shock (PAM ≥65 mmHg y adecuada perfusión tisular) dentro de las primeras 6 horas de la reanimación inicial con el uso precoz de NE. Los investigadores encontraron un control del shock significativamente mayor en el grupo de NE precoz (76,1% vs. 48,4%; p <0,001). Recientemente, un metaanálisis de 5 estudios clínicos incluyendo 929 pacientes, documentó que el inicio precoz de NE redujo significativamente el tiempo requerido para alcanzar una PAM ≥65 mmHg32.
Momento de inicio de norepinefrina y su impacto sobre variables fisiológicas y desenlace clínico
Efecto sobre el aporte de fluidos: La hipotensión arterial diastólica (<40 mmHg) o un índice diastólico (FC/PAD) >2, son señales de vasoplejia severa33. La hipotensión diastólica no es corregible con aporte de fluidos. Limitarse a ello y/o retrasar el inicio de vasopresores para cuando el paciente ya no sea respondedor, puede llevar a sobrecarga hídrica, edema visceral y agravamiento de las disfunciones orgánicas34,35,36,37. Adicionalmente, los pacientes con shock séptico y falla ventricular derecha tienen pobre respuesta al aporte de fluidos y se encuentran en alto riesgo de congestión venosa38,39. La NE puede incrementar el volumen sanguíneo estresado y la presión media de llenado sistémico a través de la vasoconstricción del lecho venoso40. Adda et al.41, en un estudio fisiológico en 30 pacientes con shock séptico, demostraron que la infusión concomitante de NE puede potenciar el efecto hemodinámico de la administración de fluidos. Por otra parte, el análisis de una cohorte retrospectiva de 213 pacientes con shock séptico42, documentó que el inicio precoz de NE (≤2 horas) se asoció a una menor cantidad de fluidos infundidos en las primeras 24 horas (6,2 ± 0,6 litros vs. 6,9±0,7 litros; p <0,001). Ospina-Tascon et al.43 evaluaron el impacto del inicio muy precoz de NE (antes o dentro de la primera hora de administrado el primer bolo de fluidos) en comparación con un inicio más tardío (>1 hora después del primer bolo de fluidos) en 337 pacientes con shock séptico. Estos autores encontraron que el inicio muy precoz de NE estuvo asociado a un menor balance neto de fluidos a las 8 y 24 horas (p <0,001), sin evidenciarse un aumento en la proporción de pacientes con insuficiencia renal aguda o requerimiento de terapia de reemplazo renal. Recientemente, un metaanálisis reportó que los pacientes en los que se inició precozmente NE recibieron significativamente menos fluidos en las primeras 6 horas de reanimación del shock séptico32.
Aumento del gasto cardíaco: En los últimos años se ha vuelto más evidente en la literatura que la infusión de NE tiene un efecto positivo sobre el gasto cardíaco, a través de diversos mecanismos. La NE incrementa el volumen circulante efectivo y la precarga mediante estimulación adrenérgica α1. Adicionalmente, aumenta la perfusión coronaria, lo que sumado al efecto Anrep (aumento de la fosforilación de los canales de calcio entre los túbulos transversales y el sarcolema), mejora la contractilidad miocárdica y por ende el volumen sistólico. Por otra parte, la estimulación β1 adrenérgica mejora directamente la contractilidad miocárdica y el acoplamiento ventrículo-arterial. Todos estos mecanismos combinados explican el mejor rendimiento cardíaco observado12,13,14. Hamzaoui et al.44 estudiaron el efecto del inicio precoz de NE sobre la funcionalidad cardiovascular en 105 pacientes con shock séptico. Se empleó termodilución transpulmonar para evaluar los cambios hemodinámicos originados por la titulación de la infusión de NE para alcanzar una PAM ≥65 mmHg. Los autores pudieron evidenciar un aumento del índice cardíaco (IC) de 3,2±1,0 a 3,6±1,1 L/min/m2, índice de volumen sistólico de 34±12 a 39±13 mL/m2, índice de volumen global al final de la diástole de 694±148 a 742±168 mL/m2, y del índice de función cardíaca de 4,7±1,5 a 5,0±1,6 por min, sin que se produjera un cambio significativo de la frecuencia cardíaca (98±21 vs. 97±19). El mismo grupo de investigadores45, llevó a cabo un estudio fisiológico para determinar si la administración de NE podía incrementar la contractilidad cardíaca en pacientes hipotensos (<65 mmHg) durante la fase inicial de la reanimación del shock séptico (<3 horas). Se realizaron mediciones ecocardiográficas previo al inicio de NE (T0) y luego de alcanzar una PAM ≥65 mmHg (T1). Los pacientes presentaron un incremento significativo de la fracción de eyección del ventrículo izquierdo (FEVI) y de la integral velocidad-tiempo del tracto de salida del ventrículo izquierdo (VTI). Adicionalmente, el aumento de estas variables fue más notorio en los pacientes que tenían FEVI <45%.
Mejoría en la microcirculación: Durante la evolución del shock séptico se pueden desarrollar severas perturbaciones del flujo sanguíneo microvascular. La pronta restauración de las alteraciones microcirculatorias puede ofrecer una mayor probabilidad de supervivencia46,47. George et al.48 llevaron a cabo un estudio observacional prospectivo en 28 pacientes con shock séptico severamente hipotensos. Para la evaluación del flujo microvascular utilizaron un dispositivo de espectroscopía del infrarrojo cercano (NIRS) capaz de medir la saturación de oxígeno del tejido muscular (StO2) y sus cambios durante una prueba de oclusión vascular en la eminencia tenar, que se llevó a cabo antes y después del inicio de NE. Los resultados se compararon con voluntarios sanos. La administración de NE se asoció a un mejoramiento significativo de las variables analizadas, evidenciándose un aumento de la StO2 de 75±9 a 78±9% (p <0,05) y en la pendiente de recuperación de la StO2 de 1,0±0,6 a 1,5±0,7%/s (p <0,05), además de un incremento de la PAM e IC.
Mortalidad: Un estudio de una cohorte retrospectiva de pacientes con shock séptico evaluó el impacto del retardo en el inicio de NE sobre la mortalidad41. Los autores documentaron una fuerte asociación entre el momento de la administración del vasopresor y la mortalidad registrada a 28 días. Por cada hora de retardo en el inicio de NE en las primeras 6 horas de reanimación del shock séptico se observó un 5,3% de incremento en la mortalidad. Adicionalmente, se encontró una mortalidad de 30,4% cuando la NE fue iniciada dentro de las primeras 2 horas en comparación al 65,2% cuando fue iniciada después de las primeras 6 horas. Un análisis retrospectivo que evaluó el inicio muy precoz de NE en comparación a un inicio tardío43, en dos grupos de 93 pacientes pareados por puntaje de propensión, documentó un menor riesgo de muerte a 28 días en el primer grupo (HR 0,31; CI95% 0,17-0,57; p <0,001).
Recientemente, un metaanálisis32 ha reportado una menor mortalidad a corto plazo (28-30 días y mortalidad hospitalaria) en pacientes con shock séptico que recibieron NE en forma precoz (odds ratio [OR] = 0,45; 95% CI; 0,34 a 0,61; p <0,00001).
Conclusiones
La NE es un fármaco ampliamente usado e indispensable en los servicios de urgencias, pabellón y UCI. Los datos existentes muestran que el inicio precoz de NE puede incrementar el gasto cardíaco por un aumento de la presión media de llenado sistémico, retorno venoso y contractilidad cardíaca. Estudios clínicos han encontrado un efecto beneficioso en términos de reducir el aporte de fluidos, acortar la duración de la hipotensión, optimizar el rendimiento cardíaco y mejorar el flujo microcirculatorio. Algunos autores incluso han documentado una asociación entre el inicio precoz de NE y una menor probabilidad de un mal desenlace. No obstante, aún se requieren de estudios clínicos de mejor diseño metodológico que corroboren esta aparente reducción de la mortalidad. Hasta disponer de nueva información que permita hacer una recomendación más amplia, los clínicos podrían considerar el inicio precoz de NE (junto o después del primer bolo de fluidos) en pacientes con hipotensión severa (PAM <50 mmHg), presión arterial diastólica <40 mmHg o un índice diastólico >2, y en aquéllos con evidencia ecocardiográfica de falla de ventrículo derecho.
Referencias
- Vincent JL, De Backer D. Circulatory shock. N Engl J Med 2013; 369: 1726-1734.
- Long B, Koyfman A, Modisett KL, Woods CJ. Practical Considerations in Sepsis Resuscitation. J Emerg Med 2017; 52: 472-483.
- Levy B, Fritz C, Tahon E, et al. Vasoplegia treatments: The past, the present, and the future. Crit Care 2018; 22: 1-11.
- Sautner T, Wessely C, Riegler M, et al. Early effects of catecholamine therapy on mucosal integrity, intestinal blood flow, and oxygen metabolism in porcine endotoxin shock. Ann Surg 1998; 228: 239-248.
- De Backer D, Creteur J, Silva E, Vincent JL. Effects of dopamine, norepinephrine, and epinephrine on the splanchnic circulation in septic shock: which is best? Crit Care Med 2003; 31: 1659-1667.
- Hernandez G, Bruhn A, Romero C, et al. Management of septic shock with a norepinephrine-based haemodynamic algorithm. Resuscitation 2005; 66: 63-69.
- Nygren A, Thorén A, Ricksten SE. Norepinephrine and intestinal mucosal perfusion in vasodilatory shock after cardiac surgery. Shock 2007; 28: 536-543.
- Cardenas-Garcia J, Schaub KF, Belchikov YG, et al. Safety of peripheral intravenous administration of vasoactive medication. J Hosp Med 2015; 10: 581-585.
- Futier E, Lefrant JY, Guinot PG. Inpress Study Group. Effect of Individualized vs standard blood pressure management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery: A randomized clinical trial. JAMA 2017; 318: 1346-1357.
- Lewis T, Merchan C, Altshuler D, Papadopoulos J. Safety of the Peripheral Administration of Vasopressor Agents. J Intensive Care Med 2019; 34 :26-33.
- Perner A, Cecconi M, Cronhjort M, et al. Expert statement for the management of hypovolemia in sepsis. Intensive Care Med 2018; 44: 791-798.
- Smulyan H, Cuddy RP, Eich RH. Hemodinamic effects of pressor agents in septic and myocardial infarction shock. JAMA 1964; 190: 188-194.
- Brown RS, Carrey JS, Mohr PA, et al. Comparative evaluation of sympathomimetic amines in clinical shock. Circulation 1966; 34: 260-271.
- Martin C, Papazian L, Perrin G, Saux P, Gouin F. Norepinephrine or dopamine for the treatment of hyperdynamic septic shock? Chest. 1993 Jun; 103(6): 1826-1831.
- De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 2010; 362: 779-789.
- Avni T, Lador A, Lev S, et al. Vasopressors for the Treatment of Septic Shock: Systematic Review and Meta-Analysis. PLoS One 2015; 10: e0129305.
- Hernández G, Teboul JL, Bakker J. Norepinephrine in septic shock. Intensive Care Med 2019; 45: 687-689.
- De Backer D, Pinsky M. Norepinephrine improves cardiac function during septic shock, but why? Br J Anaesth 2018; 120: 421-424.
- Hamzaoui O, Scheeren TWL, Teboul JL. Norepinephrine in septic shock: When and how much? Curr Opin Crit Care 2017; 23: 342-347.
- Lambden S, Creagh-Brown BC, Hunt J, et al. Definitions and pathophysiology of vasoplegic shock. Crit Care 2018; 22: 174.
- Peake SL, Delaney A, Bailey M, et al. Goal-directed resuscitation for patients with early septic shock. N Engl J Med 2014; 371: 1496-1506.
- Yealy DM, Kellum JA, Huang DT, et al. A randomized trial of protocol-based care for early septic shock. N Engl J Med 2014; 370: 1683-1693.
- Mouncey PR, Osborn TM, Power GS, et al. Trial of early, goal-directed resuscitation for septic shock. N Engl J Med 2015; 372: 1301-1311.
- Romero CM, Luengo C, Regueira T, et al. Recomendaciones SOCHIMI para el manejo inicial de la sepsis. Rev Chil Med Intensi 2017; 32: 107-126.
- Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Crit Care Med 2021; 49: e1063-e1143.
- Asfar P, Meziani F, Hamel JF, et al. High versus low blood-pressure target in patients with septic shock. N Engl J Med 2014; 370: 1583-1593.
- Cecconi M, De Backer D, Antonelli M, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med 2014; 40: 1795-1815.
- Varpula M, Tallgren M, Saukkonen K, et al. Hemodynamic variables related to outcome in septic shock. Intensive Care Med 2005; 31: 1066-1071.
- Dünser MW, Takala J, Ulmer H, et al. Arterial blood pressure during early sepsis and outcome. Intensive Care Med 2009; 35: 1225-1233.
- Levy MM, Evans LE, Rhodes A. The Surviving Sepsis Campaign Bundle: 2018 Update. Crit Care Med 2018; 46: 997-1000.
- Permpikul C, Tongyoo S, Viarasilpa T, et al. Early use of norepinephrine in septic shock resuscitation (CENSER). A randomized trial. Am J Respir Crit Care Med 2019; 199(9): 1097-1105.
- Li Y, Li H, Zhang D. Timing of norepinephrine initiation in patients with septic shock: A systematic review and meta-analysis. Crit Care 2020; 24: 488.
- Lamia B, Chemla D, Richard C, Teboul JL. Clinical review: Interpretation of arterial pressure wave in shock states. Crit Care 2005; 9: 601-606.
- Murphy CV, Schramm GE, Doherty JA, et al. The importance of fluid management in acute lung injury secondary to septic shock. Chest 2009; 136: 102-109.
- Shum HP, Lee FM, Chan KC, Yan WW. Interaction between fluid balance and disease severity on patient outcome in the critically ill. J Crit Care 2011; 26: 613-619.
- Kirkpatrick AW, Roberts DJ, De Waele J, et al. Intraabdominal hypertension and the abdominal compartment syndrome: Updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med 2013; 39: 1190-1206.
- Pereira BM. Abdominal compartment syndrome and intra-abdominal hypertension. Curr Opin Crit Care 2019; 25: 688-696.
- Vieillard-Baron A, Prigent A, Repessé X, et al. Right ventricular failure in septic shock: Characterization, incidence and impact on fluid responsiveness. Crit Care 2020; 24: 630.
- Beaubien-Souligny W, Rola P, Haycock K, et al. Quantifying systemic congestion with Point-Of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J 2020; 12: 16.
- Persichini R, Silva S, Teboul JL, et al. Effects of norepinephrine on mean systemic pressure and venous return in human septic shock. Crit Care Med 2012; 40: 3146-3153.
- Adda I, Lai C, Teboul JL, et al. Norepinephrine potentiates the efficacy of volume expansion on mean systemic pressure in septic shock. Crit Care 2021; 25: 302.
- Bai X, Yu W, Ji W, et al. Early versus delayed administration of norepinephrine in patients with septic shock. Crit Care 2014; 18: 532.
- Ospina-Tascón GA, Hernandez G, Alvarez I, et al. Effects of very early start of norepinephrine in patients with septic shock: A propensity score-based analysis. Crit Care 2020; 24: 52.
- Hamzaoui O, Georger JF, Monnet X, et al. Early administration of norepinephrine increases cardiac preload and cardiac output in septic patients with life-threatening hypotension. Crit Care 2010; 14: 5-12.
- Hamzaoui O, Jozwiak M, Geffriaud T, et al. Norepinephrine exerts an inotropic effect during the early phase of human septic shock. Br J Anaesth 2018; 120: 517-524.
- Dubin A, Henriquez E, Hernández G. Monitoring peripheral perfusion and microcirculation. Curr Opin Crit Care 2018; 24: 173-180.
- Bakker J, Ince C. Monitoring coherence between the macro and microcirculation in septic shock. Curr Opin Crit Care 2020; 26: 267-272.
- Georger JF, Hamzaoui O, Chaari A, et al. Restoring arterial pressure with norepinephrine improves muscle tissue oxygenation assessed by near-infrared spectroscopy in severely hypotensive septic patients. Intensive Care Med 2010; 36: 1882-1889.
¿CÓMO CITAR?
- APA
- Chicago
- Harvard
