Capnografía volumétrica y su aplicación en la monitorización de la ventilación mecánica
- Trabajo de Revisión
- 376 vistas
ABSTRACT
La capnografía volumétrica proporciona la visualización continua y no invasiva de la concentración del dióxido de carbono en el volumen exhalado. Los datos obtenidos están influenciados por cambios en la ventilación, perfusión y metabolismo. Por tal motivo, conocer el comportamiento de cada una de estas variables, permite realizar un adecuado análisis e interpretación del espacio muerto y ventilación alveolar.
La elaboración de este artículo brinda una revisión basada en la evidencia de los potenciales usos de la capnografía volumétrica. En primera instancia, se realizará una explicación de los principios fisiológicos subyacentes a la cinética del dióxido de carbono y de la ventilación alveolar. Luego se desarrollarán las fórmulas que permiten obtener los valores de espacio muerto. Por último se pondrán en manifiesto los trabajos que han proporcionado información de índole fisiológico para la programación de la ventilación mecánica como así también las evidencias clínicas con implicancias pronósticas en relación a este tipo de monitoreo.
INTRODUCCIÓN
La ventilación alveolar como parámetro fisiológico de monitoreo, es pocas veces pesquisada en los Cuidados Intensivos, quedando relegada tan solo a un modesto análisis de la presión parcial de dióxido de carbono en sangre arterial (PaCO2) y al registro gráfico del dióxido de carbono (CO2) en relación al tiempo espiratorio, obtenido por capnógrafos convencionales. Sin embargo, existen desde hace varias décadas, diversos equipos tecnológicos que permiten identificar las variaciones que ocurren en el espacio muerto y la ventilación alveolar en forma no invasiva y respiración a respiración. Estos son los “capnógrafos volumétricos” donde su principal distinción es integrar el CO2 al volumen del gas espirado [1].
Estos equipos permiten obtener el registro de diversas variables fisiológicas que son de compleja interpretación, como las relacionadas a la ventilación y perfusión alveolar. Afortunadamente, han sido incorporados a la práctica clínica para ser utilizados en la programación personalizada del ventilador mecánico y en la estratificación de riesgos de los pacientes con insuficiencia respiratoria, siendo un monitoreo sin precedentes para los pacientes en ventilación mecánica [2]. Sorprendentemente, en ningún ensayo clínico aleatorizado de pacientes con síndrome de distrés respiratorio agudo (SDRA), se han presentado datos analíticos sobre el espacio muerto. Esta falta de evidencia, sumado a que su medición e interpretación son todavía considerados difícil de analizar y registrar, han impedido que el espacio muerto y la ventilación alveolar sean partícipes de la última definición de SDRA [3].
Adicionalmente, es necesario destacar que para el adecuado uso de los capnógrafos volumétricos, se debe disponer de conocimientos fisiológicos sobre la cinética del CO2, ya que los resultados obtenidos, se encuentran influenciados por múltiples variables relacionados con el metabolismo celular y gasto cardíaco. Por tal motivo su desconocimiento podría generar interpretaciones erróneas de los resultados y conducir a estrategias ventilatorias potencialmente deletéreas para los pacientes [4].
Bases Fisiológicas
Cinética del CO2
La cinética del CO2 tiene un comportamiento unidireccional, que comienza con la producción aeróbica o anaeróbica a nivel tisular, continúa con su transporte a través del flujo sanguíneo y finaliza con su eliminación, principalmente a través de la ventilación alveolar. Se detallarán a continuación, cada fase en la que se encuentra implicado el CO2 [4].
1. Producción de CO2:
El CO2 deriva del producto del metabolismo celular y se acumula en el organismo en forma de depósitos. Los huesos, las proteínas plasmáticas y disuelto en los líquidos extracelulares, son los principales sitios de concentración. La producción de CO2 en condiciones basales es de aproximadamente 250 ml/min. Los estados hipermetabólicos como la fiebre, convulsiones y sepsis, se encuentran asociados a un incremento de su producción. Por otro lado, existen estados metabólicos con baja producción de CO2 en el organismo, como los generados por la hipotermia, las drogas anestésicas o los relajantes neuromusculares [5,6].
2. Transporte de CO2:
Es un gas que difunde fácilmente de los diferentes compartimentos corporales a través de gradientes de presión. De esta manera ingresa al torrente sanguíneo y es transportado hacia el pulmón por el bicarbonato, unido la hemoglobina (carbaminohemoglobina) y en menor medida disuelto en plasma para ser eliminado en cada ciclo respiratorio. La velocidad con que llega a los diferentes sitios de eliminación, está determinado por el retorno venoso o el gasto cardíaco [7].
3. Eliminación de CO2:
La principal vía de eliminación del CO2 es a través de la ventilación. Para que se lleve a cabo, debe existir una adecuada relación entre la ventilación y perfusión alveolar (relación V/Q). El CO2 es un gas que es transportado por el flujo sanguíneo, alcanza la microcirculación pulmonar y se vierte al compartimiento alveolar para ser eliminado durante la fase espiratoria. Este gas, fuera del organismo puede ser registrado por sensores de flujo que están conectados a capnógrafos volumétricos, brindando información sobre la perfusión pulmonar efectiva y el espacio muerto. Por otro lado, es también un marcador de perfusión pulmonar inefectiva o shunt, permitiendo identificar al CO2 que no es eliminado por la ventilación y que transcurre directamente hacia la circulación sistémica [7,8].
En menor proporción existen otras vías de eliminación del CO2. A nivel de la mucosa gástrica, el CO2 puede ser medido por tonometría, permitiendo valorar el comportamiento del flujo sanguíneo esplácnico. De esta manera, la tonometría gástrica puede ser utilizado como objetivo de reanimación en pacientes con trastornos perfusionales, aunque actualmente esta técnica se encuentren en desuso [9].
Capnografía volumétrica
El CO2 eliminado en fase espiratoria puede expresarse como un valor numérico denominado capnometría o como un registro gráfico denominado capnografía. Los capnógrafos convencionales permiten obtener un registro gráfico y numérico del CO2 en relación al tiempo. Por otro lado, los capnógrafos volumétricos reciben la información de sensores de flujos que se encuentran adaptados a analizadores infrarrojos de CO2, permitiendo integrar en forma simultánea y en tiempo real, el CO2 al volumen corriente espirado. La principal diferencia con la capnografía convencional, es que permite medir el volumende CO2 espirado por respiración (VTCO2br) o por minuto (VCO2). A partir de estos registros se realizan una serie de cálculos matemáticos que nos permiten estimar el espacio muerto y la ventilación alveolar en forma dinámica y no invasiva [10].
Existen dos modelos de sensores actualmente disponibles, denominadosmaisntream o de flujo central y sidestream o de flujo lateral.Losmainstream son sensores de CO2/volumen que se encuentran en el extremo distal del tubo oro-traqueal y llevan la información a un dispositivo externo mediante una señal eléctrica. Los sensores sidestream, se encuentran dentro de los dispositivos externos, sin tomar contacto con el instrumental del paciente. Estos toman una muestra de gas proveniente del paciente que es analizada y procesada en el interior del equipo [11].
Funciones de la capnografía volumétrica
Monitor metabólico: El registro de la VCO2 es un indicador de metabolismo celular, tanto en condiciones aeróbicas como anaeróbicas. Su valor se incrementa en estados hipermetabólicos y se reduce en condiciones de metabolismo celular disminuido. Para que no se generen errores en su interpretación, no deben existir variaciones en la ventilación alveolar ni en el gasto cardíaco [12].
Monitor de la ventilación e intercambio gaseoso: Por su cinética unidireccional, que va desde la célula al medio ambiente, el CO2 es un marcador de la ventilación alveolar. La mejor forma de evaluar la eficacia o ineficiencia ventilatoria es con el análisis del espacio muerto. Para que no se generen errores en su interpretación, tanto el metabolismo celular como el gasto cardíaco, se deben mantener en condiciones constantes. Por otro lado se requiere que el aire inspirado este libre de CO2, condición que se respeta en sujetos conectados a ventilación mecánica [2].
Monitor de la perfusión pulmonar y gasto cardíaco: La única vía de llegada del CO2 a los alvéolos es a través del flujo sanguíneo pulmonar. Cuando el CO2 logra eliminarse por la ventilación, se denomina perfusión pulmonar efectiva. El CO2 que se registra a la salida del tubo oro-traqueal es utilizado para calcular el gasto cardíaco, ya que su velocidad de eliminación depende del retorno venoso. Nuevamente, para evitar errores en su interpretación, la variables relacionadas al metabolismo y ventilación alveolar deben mantenerse constantes. En la interpretación de este parámetro, es clave considerar que los trastornos V/Q disminuidos o shunt, reducen la perfusión pulmonar efectiva, porque en estas circunstancias gran parte del CO2 pasa a la circulación sistémica. Por tal motivo, cuando el perfil hemodinámico es medido por esta técnica, pueden observarse falsas variaciones en el gasto cardíaco atribuidas a cambios en el shunt intrapulmonar. De esta manera a la hora de calcular el gasto cardíaco, se deben considerar los cambios del tejido pulmonar aireado y del shunt pulmonar, para no generar interpretaciones erróneas del verdadero estado hemodinámico del paciente [13, 4].
Concepto de espacio muerto y ventilación alveolar
El espacio muerto fisiológico es definido como la proporción de gas que no participa del intercambio gaseoso o como el volumen de gas pulmonar que no contiene CO2. Este volumen de espacio muerto (VD) representa un porcentaje del total del volumen corriente (VT) expresándose como fracción de espacio muerto (VD/VT), donde normalmente es menor al 30%. El resto del gas espirado, contiene CO2 que proviene de la ventilación alveolar. Por lo tanto, a un mismo volumen corriente, el incremento del espacio muerto, genera una reducción de la ventilación alveolar y viceversa.
El espacio muerto total o fisiológico (VDphys) es la resultante de la suma del espacio muerto anatómico (VDaw) con el espacio muerto alveolar (VDalv). En pacientes sometidos a anestesia y en condiciones de normalidad, el VDphys es de aproximadamente 2 ml/kg de peso teórico (en promedio 150 ml). El VDaw representa dos tercios del VDphys y normalmente es de 100 ml, mientras que el VDalv representa el resto del volumen del espacio muerto total, que en promedio es de 50 ml.
El VDaw es el volumen de gas que se encuentra alojado en la cavidad oral, laringe, tráquea y bronquios hasta los bronquiolos respiratorios. En pacientes conectados a ventilación mecánica el VDaw se incrementa con el instrumental utilizado. En este punto, es importante señalar la importancia del volumen que contienen los diferentes dispositivos conectados a la vía aérea artificial, tales como tubos orotraqueales, humidificadores pasivos, inhaladores en linea y aerocámaras ya que pueden generar incrementos del espacio muerto y disminución de la ventilación alveolar, generando secundariamente hipercapnia [14]. El VDaw también está relacionado proporcionalmente con la talla del sujeto y no así con el índice de masa corporal o el peso del paciente.
El VDalv hace referencia al volumen de gas que ingresa al compartimiento alveolar, pero no participa del intercambio gaseoso, debido a la presencia de alvéolos no perfundidos. Su resultado puede ser obtenido por la diferencia entre el VDphys con el VDaw [4,15,16].
Tabla 1. Siglas y fórmulas para el cálculo de espacio muerto.
| VDphys = VDaw + VDalv |
VDalv = VDphys - VDaw |
VTalv = VT - VDaw |
VTefec = VTalv - VDalv |
Espacio muerto fisiológico (VDphys) = Espacio muerto anatómico mas espacio muerto alveolar
Espacio muerto alveolar (VDalv) = Espacio muerto fisiológico menos espacio muerto anatómico
Volumen corriente alveolar (VTalv) = Volumen corriente menos espacio muerto anatómico
Volumen alveolar efectivo (VTefec) = Volumen corriente alveolar menos el espacio muerto alveolar
Mediciones y cálculos de la fracción de espacio muerto
El porcentaje de espacio muerto del volumen espirado fue medido por primera vez hace mas de un siglo por Bohr. Este cálculo surge de la diferencia entre la presión alveolar media de CO2 (PACO2) y la presión espirada mixta de CO2 (PeCO2). La resultante de esta diferencia se divide nuevamente por la PACO2. De esta forma es posible obtener el resultado de la fracción de espacio muerto del volumen del gas exhalado [17].
Tabla 2. Fórmulas utilizadas para el cálculo de espacio muerto
VDBohr/VT : Fórmula fracción de espacio muerto por Bohr |
(PACO2 - PeCO2)/ PACO2 |
VDEnhoff/VT: Fórmula fracción de espacio muerto por Bohr-Enhoff |
(PaCO2 - PeCO2) / PaCO2 |
PACO2 : Presión alveolar media de CO2. |
VCO2 / VTalv. |
PeCO2: presión espirada mixta de CO2. |
(VTCO2br / VT) x (Pbar - PH2O) |
Presión alveolar media de CO2
Esta fórmula ha significado un desafío durante décadas, ya que la obtención de la PACO2 ha sido difícil de medir o calcular en la práctica clínica. Sin embargo, en el ámbito de la investigación, el algoritmo matemático de la técnica de eliminación de gases inertes múltiples (MIGET) ha permitido medirlo en forma indirecta. Esta técnica permite calcular la VCO2 y la VA. Mediante la relación de ambas variables se obtiene el valor de la fracción alveolar media de CO2 (FACO2). Por tal motivo, actualmente esta técnica, aunque restringida en su uso, es el gold standard para la medición de PACO2 [18 ,19]. (Tabla 2)
Presión espirada mixta de CO2
La presión espirada mixta de CO2 (PeCO2) es utilizada en la fórmula de Bohr para el cálculo del espacio muerto. Este valor representa el grado de dilución de CO2 del volumen del gas exhalado. Esta variable surge del producto entre la fracción espirada mixta de CO2 (FECO2) con la resultante del gradiente entre las presiones barométricas y de vapor de agua. Su valor promedio a nivel del mar de 18 - 20 mmHg. (Tabla 2)
Respecto de la presión de vapor de agua (PH2O), es importante señalar, que el aire exhalado es calentado a temperatura corporal normal y humidificado al 100%. La PH2O en una mezcla de gas, es independiente de la presión del aire, pero dependiente de la temperatura. Así, una PH2O a 36 °C es de 47 mmHg, correspondiendo al 6,2% del volumen exhalado.
Para la interpretación de la capnografía es también importante comprender el concepto de Body Temperature and Pressure Saturated with water vapor (BTPS, temperatura corporal presión saturada con vapor de agua) que explica como un volumen de gas, se comprime al enfriarlo. De esta manera, el volumen de gas exhalado, al salir del organismo es enfriado y comprimido, ocupando un menor volumen. Por tal motivo, es necesario que el capnógrafo ajuste los valores registrados con un factor de conversión (BTPS), para determinar el volumen real del aire espirado. Este factor corrige el volumen de aire saturado con vapor de agua a la temperatura del cuerpo para varias temperaturas. Se utiliza para convertir el flujo y volumen medidos en condiciones ambiente a las condiciones pulmonares [20].
Fórmula de Bohr-Enhoff:
Por existir grandes dificultades en la obtención del resultado de la fórmula descrita por Bohr, en el año 1948 Enhoff postulo modificar la fórmula, reemplazando la PACO2 por la PaCO2, dando origen a una nueva forma de calcular el espacio muerto. El fundamento fisiológico para reemplazar estas variables, es que la PaCO2 en condiciones de normalidad no presentaría grandes diferencias respecto al valor de PACO2 [21]. Fletcher, siendo uno de los pioneros en introducir a la capnografía volumétrica en la medición del espacio muerto, denominó la fórmula de Bohr-Enhoff como un “espacio muerto ficticio o aparente”, ya que en condiciones fisiopatológicas de relación V/Q disminuido, se sobreestiman los resultados adquiridos. Esto es debido a que los valores PaCO2 en condiciones shunt, son mayores que los de PACO2, como consecuencia de un mayor pasaje del CO2 a la circulación sistémica y a su menor eliminación por la ventilación alveolar [21].
La fórmula de Bohr-Enhoff ha sido la más utilizada en la práctica clínica, pero como se ha mencionado, los datos obtenidos no expresan el verdadero espacio muerto. Sin embargo, esta fórmula permite obtener un excelente índice de intercambio gaseoso, ya que combina todos los mecanismos de la alteración ventilación perfusión, e incluso permite predecir el pronóstico de los pacientes con SDRA [4].
Monitoreo del espacio muerto con capnografía volumétrica
Fases del capnograma (Figura2):
Fase I: Corresponde al primer volumen de gas que transcurre a través del sensor de flujo y analizador de CO2. Proviene de las vías respiratorias que no generan intercambio de CO2 y del instrumental utilizado para conectar a los circuitos del ventilador mecánico. Este volumen representa en parte, al espacio muerto anatómico. Característicamente no contiene CO2, por lo que la gráfica muestra el movimiento de un volumen de gas a lo largo del eje X, sin generar ganancia de CO2 en el eje Y. El flujo del gas en esta fase es transportado por convección.
Fase II: La fase II representa el volumen gas que deriva parcialmente de la vía aérea distal con la mezcla del gas proveniente de los alvéolos. La pendiente de la curva representa la velocidad de transición entre el gas que es transportado por convección con el gas que es transportado por difusión. Esta transición se encuentra exactamente en el punto medio de la fase II y anatomicamente es a nivel de los bronquiolos respiratorios [16,22]. Estos conceptos fueron descritos por Fowler como la técnica geométrica de la áreas iguales y actualmente son registrados por software específicos que se encuentran en los diferentes dispositivos de medición. A partir de estos conceptos se pudo identificar el punto exacto que divide al volumen corriente
en espacio muerto anatómico y en gas de contenido alveolar (Figura 1). Esta fase también proporciona información sobre los cambios de perfusión y resistencia de la vía aérea [23].
Fase III: El volumen de gas registrado en esta fase proviene directamente de los alvéolos. La pendiente de la fase III (SIII) es un marcador de flujo sanguíneo pulmonar y presenta correlación con el gasto cardíaco. El valor de CO2 registrado en el punto medio de la Fase III, corresponde al valor de la PACO2 (Figura 2). Esta teoría propuesta por Fletcher hace varias décadas, fue validada por Tusman en el año 2011 [24]. A partir de estos nuevos conocimientos fisiológicos se ha podido calcular el VD/VT de acuerdo a la fórmula de Bohr y utilizarla como la fracción real de espacio muerto. (Figura 2)
La validación de esta técnica se ha incorporado en nuevas tecnologías de capnógrafos volumétricos que disponen de software con algoritmos matemáticos específicos, que permiten calcular todas las variables relacionadas con el volumen de CO2 exhalado. El valor final de la Fase III es denominado EtCO2 y representa el último valor de CO2 espiratorio justo antes del inicio de la próxima inspiración [4]. (Figura 3)
Determinantes fisiopatológicos del aumento de la fracción VD/VT en pacientes con SDRA
El espacio muerto fisiológico es definido como una ventilación ineficaz. En pacientes con SDRA la severidad de la enfermedad esta asociado al incremento de la fracción VD/VT. El mecanismo es explicado por un detrimento del flujo sanguíneo pulmonar microcirculatorio, situación fisiopatológica que se genera en pulmones pequeños, heterogéneos y con baja distensibilidad, denominados baby lung, sumado a que esta condición incrementa las probabilidades de desarrollar altas presiones en la vía aérea y distensión alveolar [25]. Un reciente estudio experimental, ha demostrado que la hipoventilación alveolar y el incremento del espacio muerto, conlleva consecuencias funcionales negativas sobre el pulmón. Se pudo demostrar en modelos experimentales que la reducción de CO2 a nivel alveolar reduce la concentración de calcio en las células epiteliales alveolares, lo que se traduce en una reducción de la producción de surfactante generando consecuentemente áreas de colapso o atelectasias [26].
Implicancias pronósticas de la elevación de la fracción VD/VT
La elevación de la fracción VD/VT está asociada a un incremento del riesgo de muerte en pacientes con SDRA. Por cada 5% que aumenta la fracción VD/VT las probabilidades de muerte se incrementan significativamente [27]. Estos resultados fueron reproducidos en múltiples estudios analíticos observacionales de pacientes con SDRA . Debido a la complejidad en la medición e interpretación del VD/VT y que pocas veces se utiliza en el entorno de atención crítica, la relación PaO2/FiO2 sigue siendo la única variable fisiológica de medida utilizada para definir gravedad en el SDRA. Sin embargo, existe una ventana de oportunidad en el análisis del VD/VT y la implementación de estrategias que permitan su manipulación en relación al pronóstico del paciente.[28, 29]
El cociente ventilatorio ha sido propuesto como otra alternativa para estratificar riesgos en pacientes con falla respiratoria. Este es la resultante del VM x PaCO2 / VM predicho x 100 x 37,5. En dos cohortes de SDRA, se encontró una asociación independiente con un mayor riesgo de muerte [30]. El cociente ventilatorio proporciona una solución sencilla y pragmática de la monitorización de la ventilación y a su vez puede ser utilizada para estratificar pacientes con SDRA .
Aplicaciones de la capnografía volumétrica en la ventilación mecánica
Estudios recientes han permitido comprender las utilidades de la capnografía volumétrica en pacientes con SDRA. Sus resultados han podido identificar riesgos y realizar configuraciones “bedside” del soporte ventilatorio. Actualmente se disponen de diversas estrategias para titular PEEP y reducir la fracción VD/VT. A continuación, se realizará una reseña respecto a la utilización de cada estrategia.
Utilidad de la capnografía volumétrica en la titulación de PEEP:
El VD/VT se incrementa en forma proporcional a la severidad del SDRA [31]. Esta gravedad está determinada por la reducción del porcentaje del tejido pulmonar aireado. Esta reducción del tamaño pulmonar (Baby Lung) es debido a colapso, inundación o consolidación alveolar. Esto coloca a los pacientes a presentar mayor riesgo de desarrollar VILI, debido a la distensión y a cierre - reapertura de las unidades alveolares [32 - 33]. Las maniobras de reclutamiento son utilizadas con el objetivo de abrir unidades alveolares previamente colapsadas en zonas basales o dependientes de la gravedad y mantenerlas abiertas a expensas de altas presiones de la vía aérea. Cuando esto es posible se genera una mejoría de la oxigenación y mayor eliminación de CO2 reduciendo de esta forma la fracción VD/VT [34 - 35]. Sin embargo, la programación del ventilador mecánico con altos niveles de PEEP en el SDRA moderado a severo, sigue siendo en la actualidad una maniobra de frecuente utilización, que puede llevar a distensión si no se monitorizan parámetros fisiológicos. Estudios experimentales de Tusman y cols, han demostrado que el incremento de la relación VDalv/VTalv es un marcador de sobredistensión alveolar, ocasionado por altas presiones en la vía aérea. Otras de las variables que es sensiblemente afectada con los cambios presión es el VTCO2br, por lo que puede ser una herramienta útil para programar PEEP[36]. Otros estudios clínicos demostraron su utilidad para evaluar cambios en la perfusión y en la ventilación durante la titulación de PEEP de los pacientes con SDRA. [37]
Incremento de la pausa inspiratoria:
Los ventiladores mecánicos permiten configurar tiempos y pausas de la fase inspiratoria. Múltiples estudios fisiológicos han demostrado que la prolongación del tiempo de pausa inspiratoria generan una reducción en la PaCO2 [38]. Estos fenómenos fueron explicados por un incremento del tiempo medio de distribución del gas inspirado para el intercambio de gases a nivel alveolar [39]. A su vez, puede evidenciarse en el capnograma un desplazamiento hacia la izquierda del punto medio de la fase II, explicado por una reducción del VDaw o un incremento de la ventilación alveolar. Este patrón ventilatorio puede reducir el VDphys y aumentar significativamente la eliminación de CO2 [40, 41]. Esta estrategia es especialmente útil, cuando la ventilación protectora genera hipercapnia. Por lo tanto, al incrementar la pausa inspiratoria en un 20 a 40% del tiempo respiratorio total, se genera una reducción de PaCO2 y del espacio muerto, permitiendo así el uso de ventilación protectora con bajos VT y reduciendo así el riesgo de VILI. [42]
Decúbito prono:
El cambio postural de los pacientes con SDRA de supino a prono genera una secuencia de modificaciones estructurales en el parénquima pulmonar, secundario a los efectos gravitacionales y a la liberación del peso que ejercen los tejidos sobre impuestos en el pulmón, como el corazón, la caja torácica, el abdomen y el sistema linfático. De esta manera se incrementa el porcentaje de tejido pulmonar aireado permitiendo una mejoría en la oxigenación y una reducción de la PaCO2 [43 - 44]. Gattinoni publicó en un estudio retrospectivo, una mayor probabilidad de sobrevida en pacientes que lograban reducir los niveles de PaCO2 luego de colocarlos en posición prono [45]. Charron y cols. demostraron que el posicionamiento en prono redujo la presión meseta inspiratoria, la PaCO2 y la relación VDalv/VT [46]. Protti et al. investigaron la respuesta del intercambio gaseoso al posicionamiento prono midiendo el potencial de reclutamiento pulmonar con tomografía computarizada. Como es de esperarse de acuerdo a lo discutido, los cambios en los niveles de PaCO2, pero no de oxigenación, se asociaron con mayor capacidad de reclutamiento pulmonar [47].
Limitaciones de la capnografía volumétrica
Si bien es un monitoreo no invasivo que brinda información fisiológica relevante sobre la ventilación y perfusión alveolar de pacientes que se encuentran en ventilación mecánica, es una técnica pocas veces utilizada en los cuidados intensivos. El desconocimiento que existe sobre la compleja información que brindan estos dispositivos es una de las principales razones de su desuso. Ademas, no todos los dispositivos que se encuentran actualmente en el mercado brindan toda la información que es posible obtener a partir de un registro gráfico de CO2 integrado al volumen. La mayoría de los dispositivos calculan el espacio muerto, utilizando la fórmula de Bohr - Enhoff, cuando en realidad se sabe que es un índice de intercambio gaseoso relacionado al pronóstico de los pacientes con SDRA, pero está lejos de brindar información fisiológica específica, ya que sus resultados combinan todas las alteraciones de la relación V/Q. Por otro lado, existen dispositivos que sólo calculan el espacio muerto utilizando exclusivamente al punto medio de la fase II del capnograma, por lo que únicamente brindan información sobre la relación VDaw/VT. Todo lo anterior justifica el porqué se deberían conocer las especificaciones técnicas de los equipos disponibles antes de implementar este monitoreo en la práctica clínica habitual.
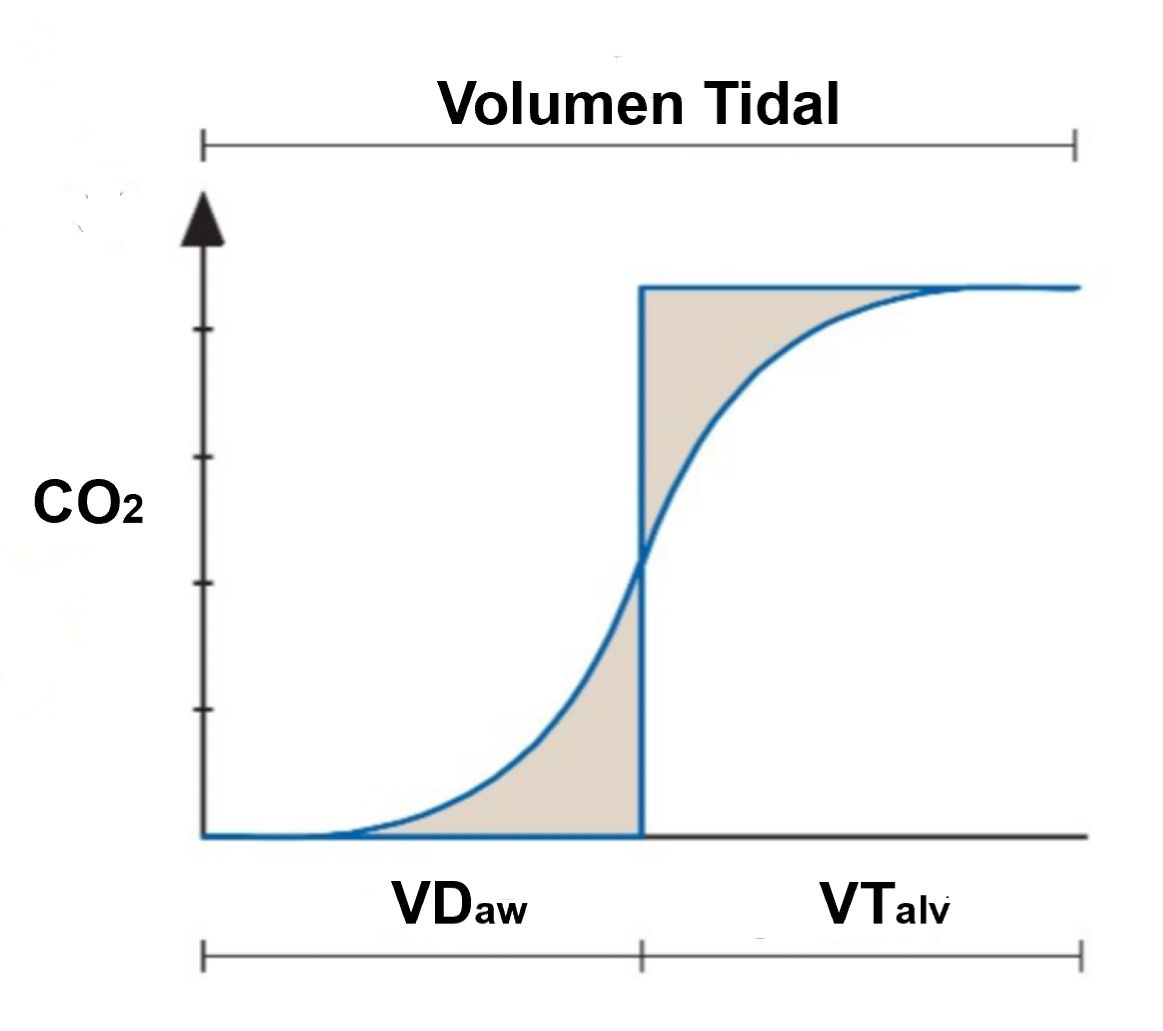
Figura 1. Punto medio de fase II con técnica geométrica de las áreas iguales.
Permite calcular el volumen de espacio muerto anatómico y el volumen de gas alveolar. Adaptado de Fowler 1948 American Physiological Society. VDaw: Espacio muerto anatómico. VTalv. Volumen corriente alveolar. CO2: dióxido de carbono.
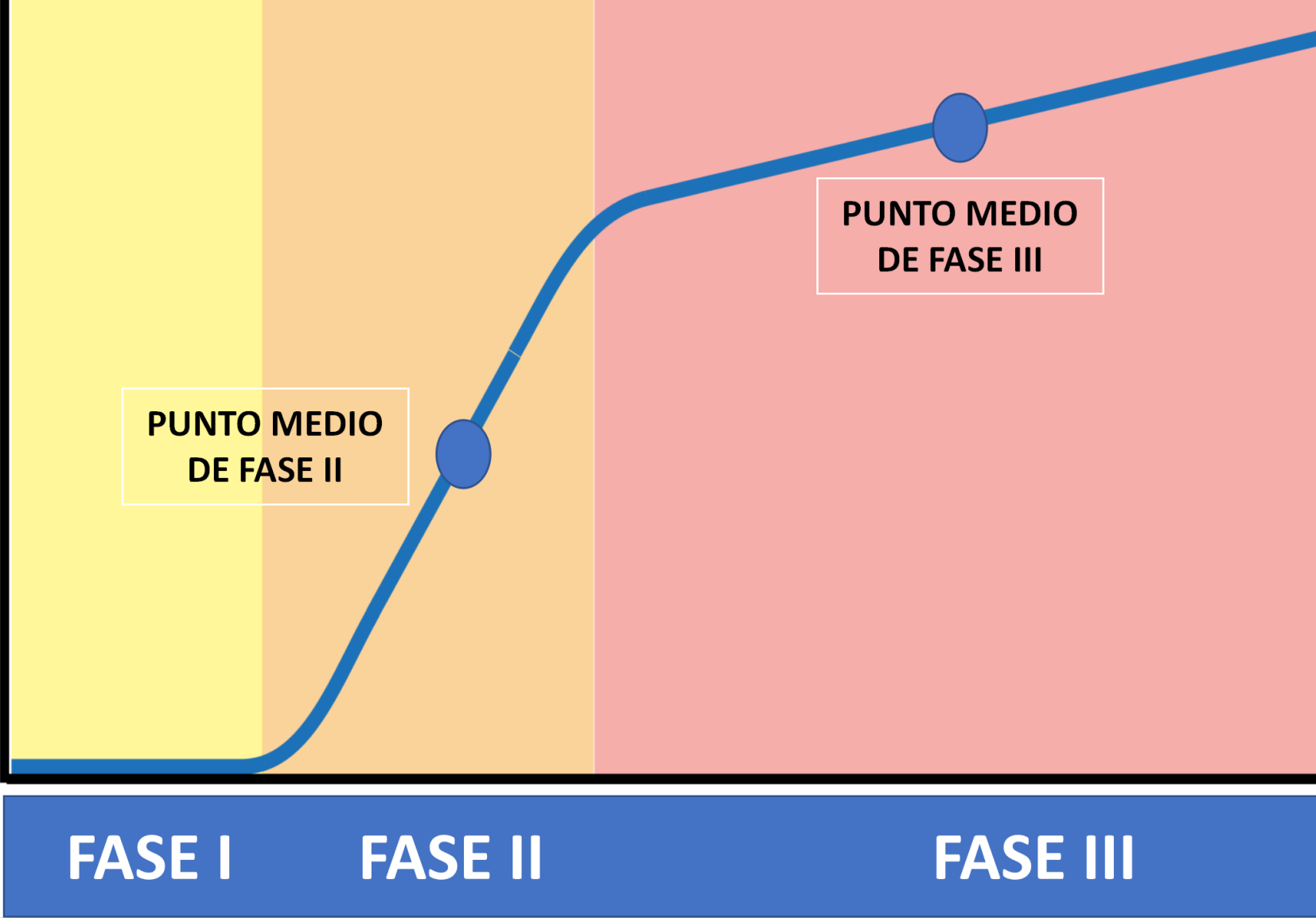
Figura 2: Capnografía volumétrica.
Fase I, Fase II y Fase III del capnograma. Punto medio de Fase II. Punto medio de Fase III
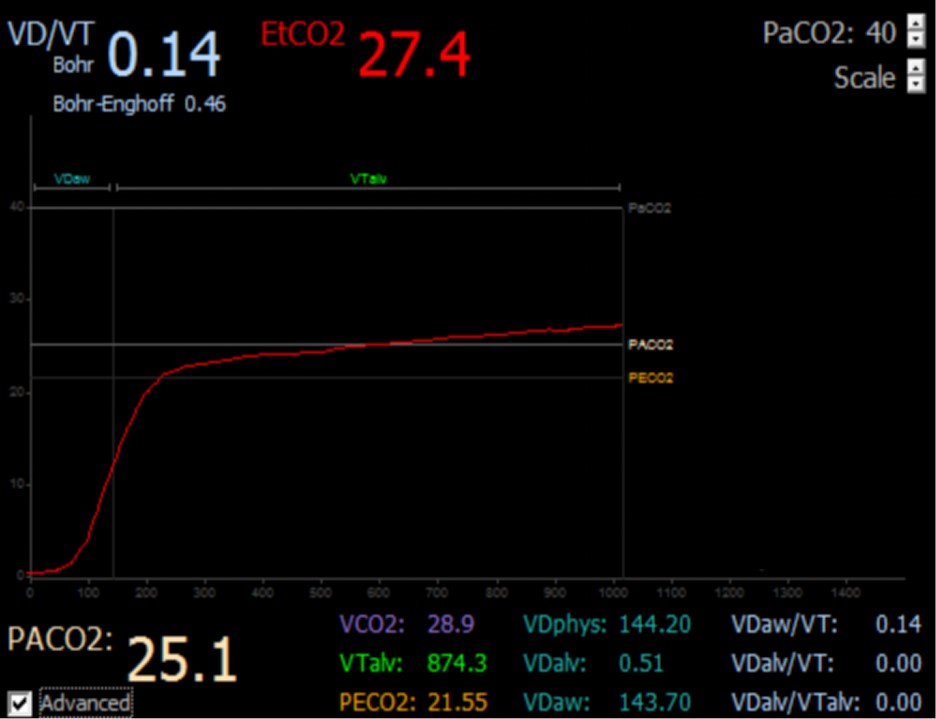
Figura 3: Nuevas tecnologías de capnógrafos volumétricos
Disponen de software con algoritmos matemáticos específicos. Permiten calcular todas las variables relacionadas al volumen de CO2 exhalado.
VCO2: Volumen de CO2 exhalado. VTalv : Volumen corriente alveolar. PeCO2: Presión expirada mixta de CO2. VDphys: Espacio muerto fisiológico. VDalv: Espacio muerto alveolar. VDaw: Espacio muerto anatómico. VDaw/VT: Relación entre espacio muerto anatómico y volumen corriente. VDalv/VT. Relación entre espacio muerto alveolar y volumen corriente. VDalv/VTalv: Relación entre espacio muerto alveolar y volumen alveolar efectivo. PACO2. Presión alveolar media de CO2. VDBohr/VT: Fracción espacio muerto muerto por Bohr. VDEnhoff/VT: Fracción espacio muerto por Bohr-Enhoff. EtCO2: End tidal CO2.
CONCLUSIONES
El uso de capnografía volumétrica requiere de un profundo conocimiento de los principios fisiológicos que involucran a la cinética del CO2, especialmente en la relación V/Q . También es necesario saber identificar, calcular y familiarizarse con los conceptos de espacio muerto fisiológico, alveolar y anatómico. Cuando se utiliza en todo su potencial, la capnografía volumétrica proporciona una gran cantidad de información sobre el metabolismo, fisiología respiratoria y cardiovascular. Nos permite realizar la programación individualizada de PEEP, evaluando la sobredistensión y colapso alveolar. Brinda además información relevante sobre el pronostico de los pacientes con SDRA. Ha llegado el momento de introducir la capnografía volumétrica en la practica rutinaria de los cuidados críticos.
BIBLIOGRAFÍA
- Kallet RH.Measuring dead-space in acute lung injury. Minerva Anestesiol, 2012 Nov;78(11):1297-305. Murias G, Blanch L, Lucangelo U. The physiology of ventilation. Respir Care, 2014 Nov;59(11):1795-807.
- Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, et al. Acute respiratory distress syndrome: The Berlin Definition. JAMA, 2012 Jun 20;307(23):2526-33.
- Suerez-Sipmann F, Bohm SH, Tusman G.. Volumetric capnography: the time has come. Curr Opin Crit Care, 2014 Jun;20(3):333-9.5
- Cherniack NS, Longobardo GS. Oxygen and carbon dioxide gas stores of the body. Physiolol Rev, 1970 Apr; 50 (2):197-243.
- Fleischer S. The metabolic production of carbon dioxide. Anesthesiology, 1960 Nov-Dec; 21:597-603.
- Tusman G, Suarez-Sipmann F, Bohm SH, Borges JB, Hedenstierna G. Capnography reflects ventilation/perfusion distribution in a model of acute lung injury. Acta Anaesthesiol Scand, 2011 May;55(5):597-606.
- Nunn JF. Elimination of carbon dioxide by the lung. Anesthesiology, 1960 Nov-Dec; 21:620-633.
- Heinonen P, Heinonen PO, Jousela IT, Blomqvist KA, Olkkola KT, Takkunen OS. Validation of air tonometric measurement of gastric regional concentrations of CO2 in critically ill septic patients. Intensive Care Med, 1997 May;23(5):524-9.
- Verscheure S, Massion PB, Verschuren F, Damas P, Magder S. Volumetric capnography: lessons from the past and current clinical applications. Crit Care, 2016 Jun 23;20(1):184.
- Balogh AL, Petak F, Fodor GH, Tolnai J, Csorba Z, Babik B. Capnogram slope and ventilation dead space parameters: comparison of mainstream and sidestream techniques.Br J Anaesth, 2016 Jul;117(1):109-17.
- Siobal MS1, Ong H, Valdes J, Tang J. Calculation of physiologic dead space: comparison of ventilator volumetric capnography to measurements by metabolic analyzer and volumetric CO2 monitor. Respir Care, 2013 Jul;58(7):1143-51.
- Gueret G, Kiss G, Khaldi S, Le Jouan R, Le Grand A, Perrament Y. Comparison of cardiac output measurements between NICO and the pulmonary artery catheter during repeat surgery for total hip replacement. Eur J Anaesthesiol, 2007 Dec;24(12):1028-33.
- Retamal J, Libuy J, Jiménez M, Delgado M, Besa C, Bugedo G, Bruhn A. Preliminary study of ventilation with 4 ml/kg tidal volume in acute respiratory distress syndrome: feasibility and effects on cyclic recruitment - derecruitment and hyperinflation.Crit Care, 2013 Jan 28;17(1):R16
- Tusman G, Gogniat E, Bohm SH, Scandurra A, Suarez-Sipmann F, Torroba A, et al. Reference values for volumetric capnography-derived non-invasive parameters in healthy individuals. J Clin Monit Comput, 2013 Jun;27(3):281-8.
- Fletcher R, Jonson B, Cumming G, Brew J. . The concept of deadspace with special reference to the single breath test for carbon dioxide. Br J Anaesth, 1981 Jan;53(1):77–88.
- Bohr C. U¨ ber die Lungeatmung. Skand Arch Physiol, 1891;2: 236–8.
- Wagner PD, Saltzman HA, West JB. Measurement of continuous distributions of ventilation-perfusion ratios: theory. J Appl Physiol, 1974 May;36(5):588–599.
- West JB. Ventilation-perfusion inequality and overall gas exchange in computer models of the lung. Respiration Physiol, 1969 Jun; 7(1):88–110.
- Hankinson JL, Viola JO, Petsonk EL, Ebeling TR. BTPS correction for ceramic flow sensor. Chest, 1994 May;105(5):1481-6.
- Enghoff H. Volumen inefficax. Bemerkungen zur Frage des scha¨dlichen Raumes. Uppsala La¨kareforen Forhandl, 1938; 44:191–218.
- Schwardt JD, Neufeld GR, Baumgardner JE, Scherer PW. Noninvasive recovery of acinar anatomic information from CO2 expirograms. Ann Biomed Eng, 1994 May; 22(3):293–306.
- Fowler WS. Lung function studies II. The respiratory dead space. Am J Physiol, 1948 Sep; 154(3):405–416.
- Tusman G, Sipmann FS, Borges JB, Hedenstierna G, Bohm SH. Validation of Bohr dead space measured by volumetric capnography. Intensive Care Med, 2011May; 37(5):870–874.
- Raurich JM, Vilar M, Colomar A, Ibanez J, Ayestaran I, Perez-Barcena J, et al. Prognostic value of the pulmonary dead-space fraction during early and intermediate phases of acute respiratory distress syndrome. Respir Care, 2010; 55(3):282–28.
- Kiefmann M, Tank S, Tritt MO, Keller P, Heckel K. Dead space ventilation promotes alveolar hypocapnia reucing surfactant secretion by altering mitochondrial function.Thorax, 2019 Mar;74(3):219-228.
- Nuckton T., Alonso JA, Kallet RH, Daniel BM, Pittet JF, Eisner MD, Matthay MA. Pulmonary dead-space fraction as a risk factor for death in the acute respiratory distress syndrome. N Engl J Med, 2002; 346(17):1281-1286.
- Lucangelo U, Bernable F, Vatua S, degrassi G, Villar A, Fernandez R et al. Prognostic value ofdifferent dead-space. Indices in mechanically ventilated patients with acute lung injury and ARDS. Chest, 2008 Jan; 133(1):62-71.
- Kallet RH, Zhuo H, Ho K, Lipnick M, et al. Lung Injury Etiology and Other Factors Influencing the Relationship Between Dead-Space Fraction and Mortality in ARDS. Respiratory care, 2017 Oct;62(10)1241-1248.
- Sinha P, Calfee C, Beitler J, Soni N, Ho K, Matthay M, et al. Physiological Analysis and Clinical Performance of the Ventilatory Ratio in Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med, 2019 Feb;199(3):333-341.
- Kallet R, Zhuo H, Ho K, Lipnick M, Gomez A, Matthay M. Lung Injury Etiology and Other Factors Influencing the Relationship Between Dead-Space Fraction and Mortality in ARDS. Respiratory Care, 2017; 62(10):1241-1248.
- Lachmann B: Open up the lung and keep the lung open. Intensive Care Med, 1992; 18(6):319–32.
- Gattinoni L, Marini JJ, Pesenti A, Quintel M, Mancebo J, Brochard L. The “baby lung” became an adult. Intensive Care Med, 2016 ;42(5):663-673.
- Kacmarek R, Villar J, Sulemanji D, Montiel R, Ferrando C, Blanco J et al. Open Lung Approach for the Acute Respiratory Distress Syndrome: A Pilot, Randomized Controlled Trial. Crit Care Med, 2016; 44(1):32-42.
- Suter PM, Fairley HB, Isenberg MD. Optimum end-expiratory airway pressure in patients with acute pulmonary failure. N Engl J Med, 1975 Feb; 292(6):284–9.
- Tusman G, Suarez-Sipmann F, Böhm S, Pech T, Reissmann H, Meschino G, et al. Monitoring dead space during recruitment and PEEP titration in an experimental model. Intensive Care Med, 2006 Nov; 32(11):1863–1871.
- Maisch S, Reismann H, Fuellekrug B, Weismann D, Rutkowski T, Tusman G et al. Compliance and dead-space fraction indicate an optimal level of positive end-expiratory pressure after recruitment in anesthetized patients. Anesth Analg, 2008 Jan; 106(1):175-81.
- Mercat A, Graïni L, Teboul JL, Lenique F, Richard C. Cardiorespiratory effects of pressure-controlled ventilation with and without inverse ratio in the adult respiratory distress syndrome. Chest, 1993; 104(3):871-875.
- Aboab J, Niklason L, Uttman L, Kouatchet A, Brochard L, Jonson B. CO2 elimination at varying inspiratory pause in acute lung injury. Clin Physiol Funct Imaging, 2007;27(1):2-6.
- Devaquet J, Jonson B, Niklason L, Si Larbi AG, Uttman L, Aboab J, et al. Effects of inspiratory pause on CO2 elimination and arterial PCO2 in acute lung injury. J Appl Physiol, 2008;105(6):1944-1949.
- Aboab J, Niklason L, Uttman L, Brochard L, Jonson B. Dead space and CO2 elimination related to pattern of inspiratory gas delivery in ARDS patients. Crit Care, 2012;16(2): R39.
- Aguirre‑Bermeo H, Morán I, Bottiroli M , Italiano S, Parrilla F, Plazolles E, et al. End‑inspiratory pause prolongation in acute respiratory distress syndrome patients: effects on gas exchange and mechanics. Ann Intensive care, 2016 Aug; 6(1):81
- Galiatsou E, Kostanti E, Svarna E, Kitsakos A, Koulouras V, Efremidis SC, et al. Prone position augments recruitment and prevents alveolar overinflation in acute lung injury. Am J Respir Crit Care Med, 2006;174(2):187-197.
- Vieillard-Baron A, Rabiller A, Chergui K, Peyrouset O, Page B, Beauchet A, et al. Prone position improves mechanics and alveolar ventilation in acute respiratory distress syndrome. Intensive Care Med, 2005;31(2):220-226.
- Gattinoni L, Vagginelli F, Carlesso E, Taccone P, Conte V, Chiumello D, et al. Decrease in PaCO2 with prone position is redictive of improved outcome in acute respiratory distress syndrome. Crit Care Med, 2003 ;31(12):2727-2733.
- Charron C, Repesse X, Bouferrache K, Bodson L, Castro S, Page B, et al. PaCO2 and alveolar dead space are more relevant than PaO2/FIO2 ratio in monitoring the respiratory response to prone position in ARDS patients: a physiological study. Crit Care, 2011 ;15(4):R175.
- Protti A, Chiumello D, Cressoni M, Carlesso E, Mietto C, Berto V, et al. Relationship between gas exchange response to prone position and lung recruitability during acute respiratory failure. Intensive Care Med, 2009;35(6):1011-1017.
¿CÃMO CITAR?
- APA
- Chicago
- Harvard
