Mal dormir en la UCI: ¿Por qué preocuparnos?
- Revisiones
- 208 vistas
Resumen
El propósito fisiológico exacto del sueño aún no se ha esclarecido completamente. Se acepta que tiene una función restauradora cerebral facilitando la eliminación de productos de degradación metabólica vinculada a la actividad neuronal. Encuestas identifican la falta de sueño como una situación muy frecuente durante la estadía en UCI. Los pacientes críticos presentan fragmentación del sueño severa. El tiempo total de sueño es generalmente normal, no obstante, experimentan 6.2 despertares por hora, determinando gran deterioro en la calidad del sueño. Predomina la vigilia y sueño superficial (N1 y N2), en desmedro de N3 y REM, determinando un sueño ligero con poca restauración fisiológica. Dado esta mala calidad del sueño, los pacientes críticos presentan somnolencia diurna, lo que se traduce en que hasta un 50% del tiempo total de sueño es diurno. La alteración en la arquitectura del sueño provoca efectos nocivos en la mayoría de los sistemas. Destacable es que produce una desestructuración importante de la homeostasis inmune. La contra regulación antiinflamatoria que ocurre en el sueño tardío normal desaparece, perdiendo su efecto modulador. Muchos fármacos empleados habitualmente en la UCI afectan negativamente la estructura del sueño. Paralelamente, factores ambientales tienen un rol preponderante en la alteración de la arquitectura y calidad de sueño en pacientes críticos. Entre ellos, la luz, el ruido y la atención clínica son particularmente importantes. Estrategias para intervenir estos factores parecen ser costo efectivas, no obstante, hay pocos estudios que incluyan medidas objetivas de impacto en el sueño.
Introducción
Desde la Antigüedad, numerosos investigadores han tratado de dilucidar la finalidad del sueño 1. Sin embargo, el propósito fisiológico exacto del sueño aún no se ha esclarecido totalmente. Se acepta que tiene una función restauradora cerebral facilitando la eliminación de productos de degradación metabólica vinculada a la actividad neuronal durante la vigilia, potencialmente tóxicos. No obstante, su alta tasa metabólica y fragilidad neuronal a desechos tóxicos, el cerebro carece de un sistema linfático. En su lugar, el líquido cefalorraquídeo ejerce la función “depurativa” recirculando e intercambiando con el líquido intersticial material de desecho como β-amiloide, proteína vinculada a enfermedades neurodegenerativas. Esto se ha llamado sistema glifático por su función similar a la eliminación linfática periférica de subproductos metabólicos. El espacio intersticial cortical aumenta más de 60% durante el sueño, provocando remoción por convección de ß-amiloide y otros tóxicos, sustentando la teoría de función restauradora del sueño en la fisiología cerebral 2. Encuestas identifican la falta de sueño como una situación muy frecuente durante la enfermedad crítica y puede prolongarse un tiempo variable posterior a la UCI 3, 4. Este artículo revisa los efectos fisiológicos de la deprivación de sueño, su impacto y los principales factores modificables que determinan el patrón patológico de sueño en la UCI.
Sueño normal versus sueño en la UCI
El sueño normal presenta dos fases: el sueño de movimiento ocular no rápido (NREM) y el sueño de movimiento ocular rápido (REM). A su vez, NREM consta de tres etapas que constituyen el 75% a 80% del tiempo total de sueño (TST). La primera etapa (N1) implica transición entre vigilia y sueño profundo. Se caracteriza por somnolencia, movimientos oculares y actividad muscular reducida. Es seguida por N2, en que existe menor conciencia del entorno y despertar fácil. Constituye del 45% a 55% de la fase NREM. La subetapa N3 se conoce como sueño de onda lenta (SWS) y se considera un período de restauración predominando actividad anabólica. Durante el sueño de onda lenta (SWS), el metabolismo es mínimo y existe reducción del consumo de oxígeno. Hay secreción de hormona del crecimiento, síntesis proteica, curación de tejidos y recuperación física. Luego, la fase REM presenta una mayor actividad cerebral y fisiológica, tasa metabólica cerebral similar a la vigilia, pero con atonía del músculo esquelético, contribuyendo a un sueño reparador. El tiempo de sueño REM aumenta durante la noche y representa del 20% al 25% de TST 5. La arquitectura normal del sueño consiste en etapas que ocurren en ciclos de 90-120 min. Una etapa de sueño "normal" en un adulto puede ser: 2-5% de N1, 45-55% de N2, 3-15% de N3 o SWS y 20-25% de REM. La transición desde vigilia al inicio del sueño ocurre en 10-20 min, y el primer período REM dentro de los 90 - 120 min 6.
Los pacientes críticos presentan fragmentación del sueño severa. El tiempo total de sueño es generalmente normal, no obstante, experimentan 6.2 despertares por hora, determinando gran deterioro en la calidad del sueño. Predomina la vigilia y sueño superficial (N1 y N2), en desmedro de N3 y REM, determinando un sueño ligero con poca restauración fisiológica. Dado esta mala calidad del sueño, los pacientes críticos presentan somnolencia diurna, lo que se traduce en que hasta un 50% del tiempo total de sueño es diurno 6,7.
Efectos fisiológicos de la privación de sueño
Variados estudios han detallado los efectos fisiológicos de la privación de sueño. A continuación, un resumen de lo conocido, con énfasis en la actividad inmune e inflamatoria dado su relevancia en los pacientes críticos.
Sistema Inmune
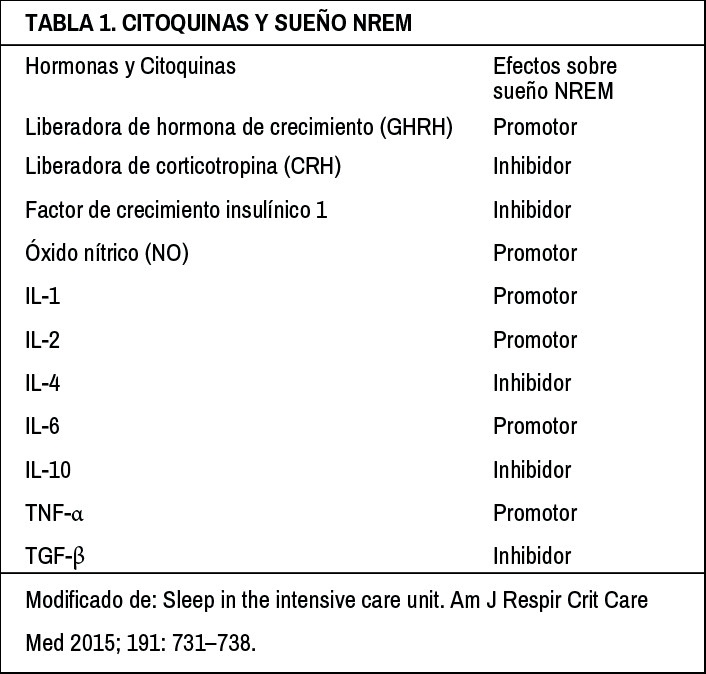
En condiciones normales, el sueño temprano de onda lenta, junto con el sistema circadiano propician un ambiente proinflamatorio favorecido por la liberación de hormona de crecimiento y prolactina, y a la vez, niveles disminuidos de cortisol y epinefrina. Esto es potenciado por acumulación de señales de peligro endógenas y exógenas durante la vigilia, actuando sinérgicamente en células inmunes lo que tiende a mejorar la respuesta, en particular la adaptativa. Hallazgos evidencian que el sueño modula selectivamente los leucocitos, reduciendo ciertas subpoblaciones de monocitos, células NK y precursores de células dendríticas, lo que es compatible con la teoría de que existe un control cerebral sobre funciones inmunes.
Durante el sueño temprano, predominan citoquinas Th1 en comparación a Th2. Hay mayor producción de IFN-γ por células Th. Durante el sueño tardío prevalece la producción de citoquinas Th2, ejemplo, IL-4 8. Esto sugiere que la acción proinflamatoria se concentra durante el período temprano del sueño nocturno, donde predominan ondas lentas. El sueño, en comparación con la vigilia nocturna, favorece la producción de citoquinas proinflamatorias, como IL-12, clave en la inducción de respuesta inmune adaptativa de tipo Th1. A su vez, la producción de IL-10, citoquina antiinflamatoria, esta reducida 9. Además, estudios señalan que el sueño aumenta la activación del complemento como lo reflejan niveles plasmáticos aumentados de C3a 10. Esta última con acción proinflamatoria y de regulación de células presentadoras de antígenos estimulando la producción de IL-12. Lo anterior, señala que el sueño podría tener un rol en la homeostasis del sistema inmune.
El sueño mejora la respuesta inmune adaptativa. Esto se demostró en un estudio que comparó sujetos que permanecieron despiertos durante la noche posterior a la administración de vacuna contra hepatitis A con sujetos que durmieron regularmente. Estos últimos mostraron el doble de títulos de anticuerpos relacionados con la vacuna a las 4 semanas. Este efecto inmuno potenciador del sueño post vacunación podría explicarse por el perfil Th1 durante el sueño temprano rico en SWS, dado en parte por la influencia hormonal de prolactina y GH que mejoran la proliferación y diferenciación de células T y citoquinas Th 1 8, 11.
La respuesta de fase aguda comprende un conjunto de cambios fisiológicos que ocurren después de una infección o injuria inflamatoria. Las manifestaciones más notables son cambios en la temperatura corporal, anorexia, inmovilidad, somnolencia y malestar general. Las citoquinas proinflamatorias son en gran parte responsables de estos síntomas. Esta respuesta es uno de los principales factores que determinan arquitectura alterada del sueño en pacientes críticos 12. La tabla 1 resume el efecto de citoquinas y hormonas sobre el sueño NREM, esencial en procesos de restauración y modulación.
La privación de sueño produce una desestructuración importante de esta homeostasis inmune. Si bien la mayoría de los estudios muestran que la reducción prolongada del sueño conduce a una mejora general en los marcadores de actividad inflamatoria, este perfil es inespecífico, relacionado principalmente con la respuesta innata. La contra regulación antiinflamatoria que ocurre en el sueño tardío normal no se produce, perdiendo su efecto modulador. De hecho, los incrementos de cortisol frente al estrés después de una prolongada privación de sueño son pequeños. Durante la deprivación prolongada del sueño las concentraciones plasmáticas de IL-6 y PCR aumentan significativamente 13, 14. Existe además una relación con mayor susceptibilidad a desarrollar infecciones. Estudios en ratas sometidas a privación prolongada de sueño, indujo un control deficiente de la población bacteriana intrínseca, resultando en infecciones y bacteremias, neutrofilia regenerativa leve y formas leucocitarias inmaduras, con perfil de citoquinas proinflamatorio principalmente IL-1b. A pesar de esta inmunoactivación, no se logró el control bacteriano, condicionando un estado de inmunosupresión. Se ha visto que la respuesta inmune a la vacunación contra la influenza se atenúa con la deprivación de sueño, existiendo mayor susceptibilidad al resfrío común 15, 16.
Estos hallazgos sugieren una “inflamación sistémica de bajo grado” producto de la deprivación prolongada de sueño, con efectividad inmune limitada. Esta inflamación se asocia con diabetes tipo 2 y enfermedades cardiovasculares 17.
Modelos animales han demostrado un efecto protector de melatonina contra la encefalitis viral, hepatitis y shock séptico; inhibe el TNF-α y reduce los niveles de IL-6, óxido nítrico sintasa inducible (iNOS) en el hígado, evitando el choque circulatorio por endotoxina. Se ha encontrado que patrones de iluminación en la UCI eliminan la regulación fisiológica de secreción de melatonina 18.
Sistema nervioso
Muchos fármacos empleados habitualmente en la UCI afectan negativamente la estructura del sueño. En la tabla 2 se describen algunos y sus efectos sobre el sueño.
La mayoría de los fármacos utilizados disminuyen las etapas N3 y REM, esenciales en funciones de restauración fisiológica. Por ejemplo, propofol, benzodiacepinas y opioides aumentan el tiempo total de sueño, con predominio de etapas N1 y N2, provocando un sueño superficial. Ello sumado a los múltiples despertares que son sometidos, afectan directamente la calidad del sueño. Por otra parte, el delirium y privación de sueño comparten varias características, como deterioro cognitivo, vigilia persistente e inefectiva, alteraciones conductuales, déficit de concentración y memoria. La deprivación de sueño puede ser un factor contribuyente de delirium, y este último provocar mayor deterioro del sueño. Esto sumado a que los fármacos utilizados para controlar el delirium pueden afectar la estructura normal del sueño, hacen complejo el abordaje del paciente delirioso. Finalmente, el delirium puede impactar negativamente en la mortalidad, mayor estadía hospitalaria y secuelas cognitivas posteriores al alta, lo que indirectamente sugiere que la deprivación de sueño, como agente promovedor de delirium también influiría en dichos resultados 19, 20, 21. La figura 1 esquematiza la interrelación entre la deprivación de sueño y delirium. La dexmedetomidina, agonista adrenérgico α-2 altamente selectivo, tendría un efecto favorable en la calidad del sueño, y podría controlar el delirium y mantener una arquitectura del sueño parecida a la normal 22, 23.
Finalmente, en una revisión de sobrevivientes a enfermedades críticas, hasta el 61% informaron falta de sueño a 6 meses. Hubo asociación con comorbilidades psicológicas y deteriorada calidad de vida, déficit cognitivo, ansiedad y trastorno de estrés postraumático. Estas alteraciones se han agrupado en el llamado síndrome post unidad de cuidados intensivos 24.

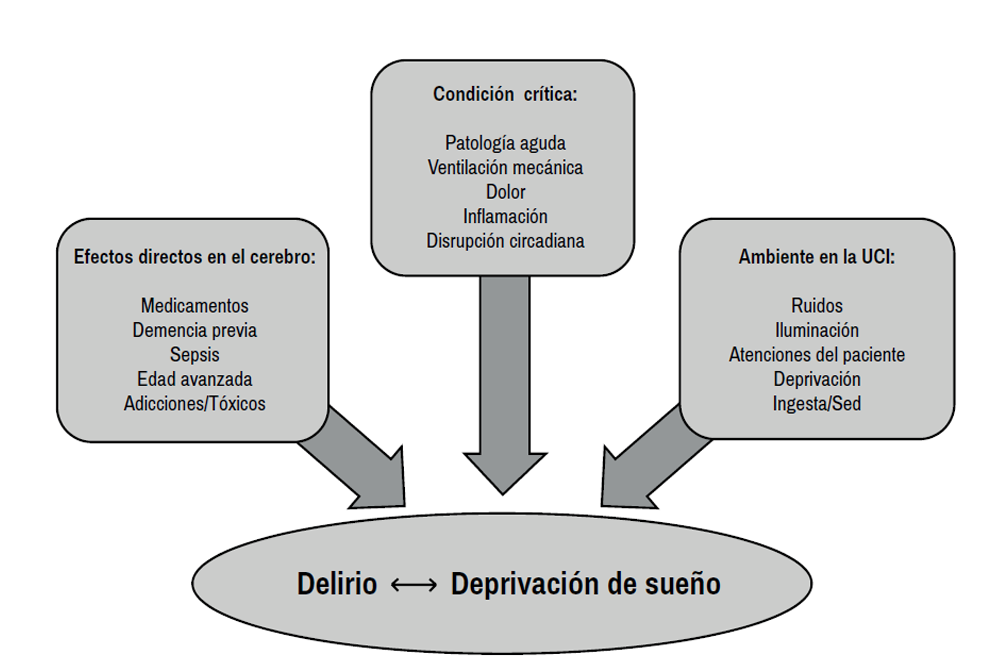
Figura 1: Factores de riesgo comunes entre Delirium y Deprivación de sueño. (Modificado de: Sleep in the intensive care unit. Am J Respir Crit Care Med 2015; 191: 731-738.)
Sistema cardio-respiratorio
Los efectos cardiovasculares son el aumento de la modulación simpática en desmedro de la parasimpática, sensibilidad barorrefleja disminuida y aumento de catecolaminas, lo que se manifiesta con aumentos en la presión arterial y frecuencia cardíaca. Esto, sumado a la condición crítica inherente, predispone a mayor riesgo de eventos coronarios y falla cardíaca, sobretodo en pacientes con patología cardiovascular previa. 25
Los efectos sobre el sistema respiratorio implican disminución de la resistencia muscular respiratoria, de la respuesta ventilatoria a la hipoxia e hipercapnia dado por una reducida quimiosensibilidad del centro respiratorio, con potencial afectación en el proceso de weaning ventilatorio 5, 26. No es infrecuente que el soporte ventilatorio durante la PSV sea excesivo, resultando en hiperventilación e hipocapnia por debajo del umbral de apnea. Sumado a esto, las asincronías de flujo, podrían contribuir a las alteraciones del sueño y al delirium, lo que podría determinar mayor duración de la ventilación mecánica. Un estudio demostró que el destete fue más prolongado en pacientes que, luego de una prueba de ventilación espontánea frustra, tenían sueño atípico y ausencia de REM versus aquellos que tenían un patrón de sueño normal 27, 28.
Sistema endocrino
Normalmente, durante el sueño nocturno existe disminución en los niveles de catecolaminas y cortisol; hay mayor liberación de hormona del crecimiento, prolactina y leptina, que provocan la activación del sistema inmunitario. En los pacientes críticos hay una producción aumentada de cortisol como respuesta a cualquier injuria o estrés. Ello contribuye a alteraciones en el ritmo circadiano, lo que, sumado a la supresión de melatonina, contribuyen a la vigilia de estos pacientes 13.
En lo metabólico, el aumento de la actividad simpática y hormonas de estrés suprimen la liberación de insulina por el páncreas, provocando estados de resistencia a insulina e hiperglicemia 29, lo que es nocivo en los pacientes críticos. Es sabido que niveles de glicemia inestables afectan negativamente la mortalidad. Además, la privación de sueño y estados de vigilia persistentes exacerban el catabolismo y aumentan el consumo de oxígeno, situación peligrosa en el período crítico agudo.
La tabla 3 resume los principales efectos sistémicos de la deprivación de sueño.

Factores que afectan el sueño de los pacientes en la UCI
Además de la inflamación sistémica inherente a la patología crítica aguda, los factores ambientales tienen un rol preponderante en la alteración de la arquitectura y calidad de sueño en pacientes críticos. Entre ellos, la luz, el ruido y atención clínica son particularmente importantes dado que se pueden intervenir. 3, 30, 31. La figura 2 ilustra los principales determinantes ambientales que afectan el sueño de los pacientes durante su estadía en UCI.
El ambiente de la UCI se caracteriza por tener altos niveles de sonido, interacciones frecuentes de atención clínica y patrones de luz anormales, lo que perturba el sueño. Los pacientes y el personal médico señalan al ruido como uno de los factores más perjudiciales para dormir en la UCI. Las alarmas de monitores, equipos, teléfonos, conversaciones, cuidados y actividades de enfermería han sido implicados en la interrupción del sueño 30, 32, 33. La Organización Mundial de la Salud (OMS) sugiere que los niveles de ruido deberían promediar 35 dBA durante el día y 30 dBA por la noche. Estudios han documentado que los niveles de ruido en la UCI son significativamente más altos que los recomendados. Se han registrado niveles de 60 dBA durante el día, con máximos sobre 100 dBA 22 a 28 veces por hora; y durante la noche sobre 85 dBA hasta 16 veces por hora 31. En un estudio con polisomnografía y monitorización de sonido, se determinó que del 11 al 24% de los despertares en pacientes de UCI son resultado directo de la emisión de ruidos 34. Dentro de las fuentes de ruidos, un gran porcentaje proviene del personal de la unidad. Existe un promedio considerable de interrupciones en el dormir nocturno de los pacientes producto de atenciones médicas. Se han documentado hasta 42,6 interrupciones durante la noche (período de 12 horas) 35. Con respecto a la luz, es importante para mantener un ritmo circadiano normal. En un día soleado los niveles de luz varían de 32.000 a 60.000 lux. En la UCI, los niveles de luz diurna varían desde 30–165 lux; los niveles de luz nocturna varían de 2.4 a 145 lux; y durante los procedimientos hasta 10.000 lux, lo que definitivamente altera el ritmo circadiano del paciente. La luz artificial nocturna afecta la secreción de melatonina, aumenta el cortisol y tiene un impacto negativo en el sueño. Es sabido que niveles de luz nocturna de 100 a 500 lux afectan la secreción de melatonina, y entre 300 y 500 lux pueden interrumpir el marcapasos circadiano. A pesar de esto, sobrevivientes han informado que la luz no perturba el sueño tanto como el ruido y la atención clínica 36, 37.
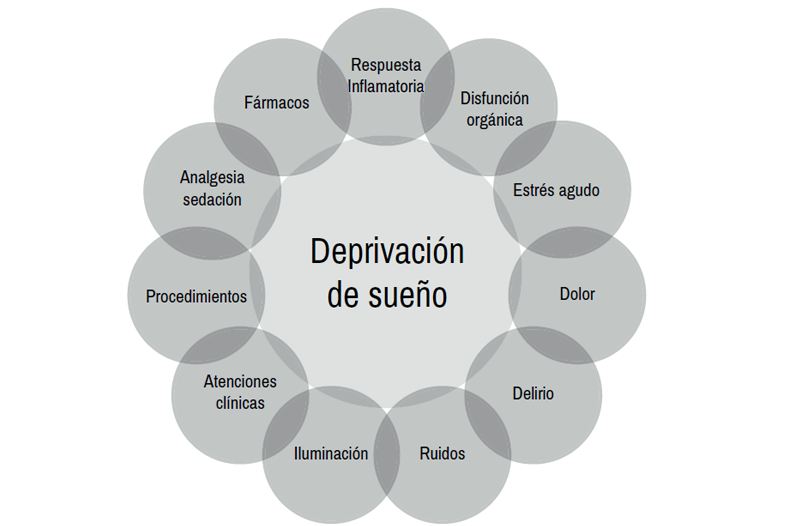
Figura 2: Determinantes fisiopatológicos y ambientales de la privación de sueño en la UCI.
Estrategias de cuidados del sueño en UCI
Mantener un entorno tranquilo y disminuir las actividades de cuidado en la noche puede ser efectivo para crear un ambiente que facilite un buen dormir en la UCI. Pareciera ser sencillo y costo efectivo realizar intervenciones a los factores modificables que alteran el sueño de nuestros pacientes. Resultados respaldan la eficacia de implementar pautas sencillas para controlar el ruido nocturno y actividades de atención en la UCI. Intervenciones como cambiar rutinas de atención de enfermería nocturna, disminuir el ruido y atenuar luces de noche han resultado efectivas para mejorar el ambiente durante el dormir y preservar el sueño. Por ejemplo, intervenciones han demostrado que alterar el ciclo de iluminación en las UCI puede tener una serie de beneficios adicionales más allá de la restauración parcial de la normalidad en los ritmos circadianos, como una mayor satisfacción del paciente. Se ha visto que la luz cíclica estimula el sistema inmunitario al mejorar la regulación de la melatonina. Estudios encontraron que la exposición a luz brillante de la mañana similar a un día soleado conduce reduce el delirium y mejora el sueño. El efecto de la reducción de ruido sobre la calidad del sueño no está del todo esclarecido. Sin bien estudios demuestran que la cantidad de sueño mejora, la calidad sigue siendo mala 38, 39.
Pocos estudios han utilizado evaluaciones objetivas del sueño. La polisomnografía hasta ahora es el único método objetivo para evaluar las etapas del sueño y el impacto que podrían tener las intervenciones en ellas. No es un examen fácil de realizar en el entorno de la UCI, por lo que ha sido utilizado en pocos trabajos. 40, 41.
Las intervenciones estudiadas en general han sido múltiples (antifaces, tapones de oídos, ambientales, etc). De los resultados, se han utilizado cuestionarios de evaluación subjetiva del sueño, como Richards Campbell (el más validado), escala del sueño Verran y Snydern Halpern, índice de calidad del sueño de Pittsburgh o cuestionarios originales (no validados). Estas estrategias parecen ser beneficiosas, respecto a duración y calidad del sueño. No obstante, hay mucha heterogeneidad en el tipo de pacientes y el momento en que se aplican estas estrategias, con escasos datos objetivos, tamaños de muestra pequeños y metodologías débiles. De las intervenciones más utilizadas, los tapones de oídos y antifaces han sido los más estudiados 41.
Conclusiones
La importancia del sueño para la salud y la recuperación de la enfermedad ha sido reconocida intuitivamente por la gran mayoría de los médicos en el transcurso de la historia. En las últimas décadas, se han realizado estudios que avalan esto. Los pacientes críticos suelen presentar vigilia patológica, predominio de sueño diurno de mala calidad, fragmentación del sueño nocturno y patrones de sueño con ausencia o escaso de sueño de onda lenta y REM, etapas esenciales en funciones de restauración fisiológica. Los efectos fisiológicos de la deprivación de sueño son conocidos, sin embargo, sigue siendo un tema poco abordado en las UCI. El entorno de la UCI juega un rol principal en la arquitectura normal del sueño. Estrategias para intervenir los factores ambientales parecen ser costo efectivas, no obstante, hay pocos estudios que incluyan medidas objetivas de impacto en el sueño.
Investigaciones futuras deberían incluir mediciones con polisomnografía para determinar el real efecto en la arquitectura del sueño y formular recomendaciones dada la relevancia de este aspecto en el cuidado del paciente crítico.
Referencias
- J. Barbera. Sleep and dreaming in Greek and Roman philosophy. Sleep Med, 9 (2008);906-910
- Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, O’Donnell J, Christensen DJ, Nicholson C, Iliff JJ, et al. Sleep drives metabolite clearance from the adult brain. Science 2013;342:373-377.
- Freedman NS, Kotzer N, Schwab RJ. Patient perception of sleep quality and etiology of sleep disruption in the intensive care unit. Am J Respir Crit Care Med. 1999; 159:1155-62.
- Weinhouse GL, Schwab RJ. Sleep in the critically ill patient. Sleep. 2006;29(5):707-716.
- Delaney LJ, Van Haren F and Lopez V. Sleeping on a problem: the impact of sleep disturbance on intensive care patients - a clinical review. Ann Intensive Care 2015;5: 3
- Collop NA, Salas RE, Delayo M, Gamaldo C. Normal sleep and circadian processes. Crit Care Clin. 2008;24:449-60.
- Elliott R, McKinley S, Cistulli P, Fien M. Characterisation of sleep in intensive care using 24 hour polysomnography: an observational study. Crit Care. 2013;17:R46.
- Dimitrov S, Lange T, Tieken S, Fehm HL, Born J (2004) Sleep associated regulation of T helper 1/T helper 2 cytokine balance in humans. Brain Behav Immun 18:341-348.
- Lange T, Dimitrov S, Fehm HL, Westermann J, Born J (2006) Shift of monocyte function toward cellular immunity during sleep. Arch Intern Med 166:1695-1700
- Reis ES, Lange T, Kohl G, Herrmann A, Tschulakow AV, Naujoks J, Born J, Kohl J (2011) Sleep and circadian rhythm regulate circulating complement factors and immunoregulatory properties of C5a. Brain Behav Immun 25(7):1416-1426
- Gala RR (1991) Prolactin and growth hormone in the regulation of the immune system. Proc Soc Exp Biol Med 198:513-527
- Krueger JM, Majde JA, Rector DM. Cytokines in immune function and sleep regulation. Handb Clin Neurol 2011;98:229-240.
- Spiegel K, Leproult R, Van Cauter E (1999) Impact of sleep debt on metabolic and endocrine function. Lancet 354:1435-1439
- Shearer WT, Reuben JM, Mullington JM, Price NJ, Lee BN, Smith EO, Szuba MP, Van Dongen HP, Dinges DF (2001) Soluble TNF-alpha receptor 1 and IL-6 plasma levels in humans subjected to the sleep deprivation model of spaceflight. J Allergy Clin Immunol 107:165-170
- Spiegel K, Sheridan JF, Van Cauter E (2002) Effect of sleep deprivation on response to immunization. JAMA 288:1471-1472
- Cohen S, Doyle WJ, Alper CM, Janicki-Deverts D, Turner RB (2009) Sleep habits and susceptibility to the common cold. Arch Intern Med 169:62-67
- Mullington JM, Simpson NS, Meier-Ewert HK, Haack M (2010) Sleep loss and inflammation. Best Pract Res Clin Endocrinol Metab 24:775-784
- Papaioannou V, Mebazaa A, Plaud B, Legrand M. ‘Chronomics’ in ICU:circadian aspects of immune response and therapeutic perspectives in the critically ill. Intensive Care Med Exp. 2014;2:18.
- Dimsdale JE, Norman D, DeJardin D, Wallace MS. The effect of opioids on sleep architecture. J Clin Sleep Med. 2007;3(1):33-6.
- Pandharipande P, Ely E. Sedative and analgesic medications: risk factors for delirium and sleep disturbances in the critically ill. Crit Care Clinics. 2006;22(2):313-27.
- Trompeo AC, Vidi Y, Locane MD, Braghiroli A, Mascia L, Bosma K, et al. Sleep disturbances in the critically ill patients: role of delirium and sedative agents. Minerva Anestesiol. 2011;77(6):604-12.
- Alexopoulou C, Kondili E, Diamantaki E, et al. Effects of dexmedetomidine on sleep quality in critically ill patients: a pilot study. Anesthesiology. 2014; 121:801-7.
- Skrobik Y, Duprey MS, Hill NS, Devlin JW. Low-dose nocturnal dexmedetomidine prevents ICU delirium. A randomized, placebo-controlled trial. Am J Respir Crit Care Med. 2018;197:1147-56.
- Altman MT, Knauert MP, Pisani MA. Sleep disturbances after hospitalization and critical illness: a systematic review. Ann Am Thorac Soc. 2017;14:1457-68.
- Salas RE, Gamaldo CE. Adverse effects of sleep deprivation in the ICU. Crit Care Clin 2008; 24 (3): 461-76
- Chen HI, Tang YR. Sleep loss impairs inspiratory muscle endurance. Am Rev Respir Dis. 1989;128(6):907-9.
- Pham T, Telias I, Piraino T, Yoshida T, Brochard LJ. Asynchrony consequences and management. Crit Care Clin. 2018;34:325-41.
- Thille AW, Reynaud F, Marie D, et al. Impact of sleep alterations on weaning duration in mechanically ventilated patients: a prospective study. Eur Respir J. 2018;51:1702465.
- Donga E, Van Dijik M, Van Dijik JG, Biermasz NR, Lammers G-J, van Kralingen KW, et al. A single night partial sleep deprivation induces insulin resistance in multiple metabolic pathways in healthy subjects. J Clin Endocrinol Metab. 2010;95(6):2963-8.
- Bihari S, Doug McEvoy R, Matheson E, Kim S, Woodman RJ, Bersten AD. Factors affecting sleep quality of patients in intensive care unit. J Clin Sleep Med 2012;8:301-307.
- Pisani MA, Friese RS, Gehlbach BK, et al. Sleep in the intensive care unit. Am J Respir Crit Care Med 2015; 191: 731-738.
- Kahn DM, Cook TE, Carlisle CC, Nelson DL, Kramer NR, Millman RP. Identification and modification of environment noise in an ICU setting. Chest. 1998;114(2):535-40.
- Gabor JY, Cooper AB, Crombach SA: Contribution of the intensive care unit environment to sleep disruption in mechanically ventilated patients and healthy subjects. Am J Resp Crit Care 2003, 167:708-715.
- Aaron JN, Carlisle CC, Carskadon MA: Environmental noise as a cause of sleep disruption in an intermediate Respiratory care unit. Sleep 1996, 19:707-710.
- Tamburri LM, DiBrienza R, Zozula R, Redeker NS. Nocturnal care interactions with patients in critical care units. Am J Crit Care 2004;13:102-112; quiz, 114-105.
- Telias I, Wilcox ME. Sleep and circadian rhythm in critical illness. Critical Care. 2019;23(1):82
- Weinhouse GL, Schwab RJ. Sleep in the critically ill patient. Sleep 2006;29:707-716.
- Engwall M, Fridh I, Johansson L, Bergbom I, Lindahl B. Lighting, sleep and circadian rhythm: an intervention study in the intensive care unit. Intensive Crit Care Nurs 2015;31:325-35
- Oldham MA, Lee HB, Desan PH. Circadian rhythm disruption in the critically ill: an opportunity for improving outcomes. Crit Care Med 2016;44:207-17.
- Xie H, Kang J, and Mills G. Clinical review: the impact of noise on patients’ sleep and the effectiveness of noise reduction strategies in intensive care units. Crit Care 2009; 13: 208
- Bion, V., Lowe, AS., Puthucheary, Z., and Montgomery, H. 2018. Reducing sound and light exposure to improve sleep on the adult intensive care unit: An inclusive narrative review. J Intensive Care Soc 19 (2): 138-146
¿CÓMO CITAR?
- APA
- Chicago
- Harvard
